
����Ŀ���µ��о����������ѣ�DME���Ƿ����й���Դ�ṹ�ص�������������ȼ�ϣ������Ѵ������������ķ�Ӧ���̣���Ҫ�������¼�����Ӧ����������Ϊ200�桢1.01��105Pa�ⶨ���� ��CH3OCH3��g��+H2O��g���T2CH3OH��g����H=+a kJmol��1
��CH3OH��g��+H2O��g���TCO2��g��+3H2��g����H=+b kJmol��1
��CO��g��+H2O��g���TCO2��g��+H2��g����H=��c kJmol��1
��CH3OH��g���TCO��g��+2H2��g����H=+d kJmol��1
��ش��������⣮
��1��д���ö�������H2ͬʱȫ��ת��ΪCO2ʱ��Ӧ���Ȼ�ѧ����ʽ ��
��2��д����Ӧ�۵�ƽ�ⳣ������ʽK= �� ���¶����ߣ��˷�Ӧ��Kֵ��������С�䣩��
��3����200����ݵ��ܱ������У�����һ�����ļ״����ʽ����ƽ�⣬���¿�����Ϊ�÷�Ӧ�ﵽƽ��״̬���ж�����Ϊ �� A�������������ܶȱ��ֲ��� B�������ƽ����Է����������ֲ���
C��CO������������ֲ��� D��CO��H2�����ʵ���֮�ȱ���1��2����
��4����ҵ�����в�ò�ͬ�¶��¸�������������������ת���ʵĹ�ϵ�ֱ���ͼ1��ͼ2��ʾ�� 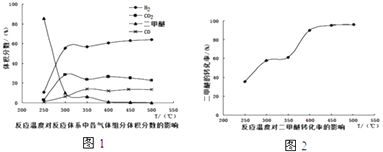
������Ϊ��ҵ�����п��Ƶ�����¶�Ϊ ��
A.250��300��B.300��350��C.350��400��D.400��450��
�����¶ȴﵽ400���Ժ�������CO2�Լ�����ͬ�ı仯���ƽ��ͣ���CO��H2���������Ҳ�Լ�����ͬ�ı仯�������ߣ��û�ѧ����ʽ��ʾ���ܵ�ԭ�� ��
��5��ijһ����̶����ܱ������н��з�Ӧ�ڣ�200��ʱ��ƽ�⣮���������ı�ʱ������ͼ3�в��仭��CO2�İٷֺ�����ʱ��仯��ͼ��t1ʱ�����£���t1��t2֮��ijʱ�̴ﵽƽ�⣻t2ʱ�����Ӵ����� 
���𰸡�
��1��CH3OCH3��g��+3H2O��g��?2CO2��g��+6H2��g������H=+��a+2b��kJ/mol
��2��![]() ����С
����С
��3��B��C
��4��D��CH3OCH3+CO2?3H2+3CO
��5��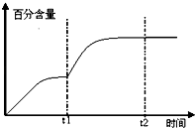
���������⣺��1����֪����CH3OCH3��g��+H2O��g��2CH3OH��g����H=+akJ/mol ��CH3OH��l��+H2O��g��CO2��g��+3H2��g����H=+bkJ/mol
�ݸ�˹���ɣ���+�ڡ�2�ã�CH3OCH3��g��+3H2O��g��2CO2��g��+6H2��g������H=+��a+2b��kJ/mol��
���Դ��ǣ�CH3OCH3��g��+3H2O��g��2CO2��g��+6H2��g������H=+��a+2b��kJ/mol����2����Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ������ʽK= ![]() ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С��
������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С��
���Դ��ǣ� ![]() ����С����3��A����Ϊ���壬����������������䣬�����ݻ����䣬������������ܶ�ʼ�ղ��䣬��A����
����С����3��A����Ϊ���壬����������������䣬�����ݻ����䣬������������ܶ�ʼ�ղ��䣬��A����
B������������������䣬�淴Ӧ���л���������ʵ�������ƽ����Է���������С������ƽ����Է����������ֲ���ʱ��˵���ﵽ�˻�ѧƽ��״̬����B��ȷ��
C��CO������������䣬˵����Ӧ����ƽ�⣬��C��ȷ��
D��CO�����������ʵ���֮��ʼ����1��2������֤���ﵽ�˻�ѧƽ��״̬����D����
��ѡ��BC����4������ͼ��֪��400��450��ʱ�������ѵ�Ũ����С��ת�����������������������ѡ��C��
���¶ȳ���400�棬�������������̼��ͬ�ı������ͣ�CO��������ͬ�ı������ߣ�˵���������������̼��1��1��Ӧ������CO�������ı�����ͬ����Ӧ�ķ���ʽΪ��CH3OCH3+CO23H2+3CO��
���Դ��ǣ�CH3OCH3+CO23H2+3CO����5��t1ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ���CO2�İٷֺ������ӣ�ͼ��Ϊ��  ��
��
���Դ��ǣ�  ��
��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��������ǿ���ǣ� ��
A.PH=4
B.C��H+��=1��10��3 molL��1
C.C��OH����=1��10��12
D.C��H+��/C��OH����=1012
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ħ������������( )
A. 8g CH4 B. 9mLH2O C. 5.6LO2(STP) D. 0.8molH2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��+3B��g��2C��g��+2D��g�������ֲ�ͬ����µķ�Ӧ�������£����б�ʾ��Ӧ���������ǣ� ��
A.v��A��=0.15 molL��1min��1
B.v��B��=0.01 molL��1s��1
C.v��C��=0.40 molL��1min��1
D.v��D��=0.45 molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��Ӧʱ�������������Ƶ������ص���( )
A. �۵�� B. Ӳ��С C. �ܶ�С D. �ܻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ���Աʹ�õ�����ƿ���Ծ���������Ϊԭ�ϣ��ס��ҡ������������Ǻϳɾ��������ֵĻ���ԭ�ϣ�����˵��������ǣ� �� 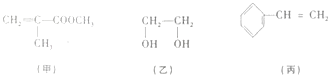
A.��������һ�������¿��������л��߷��ӻ�����
B.1mol�����ʿ���2mol����ȫ��Ӧ����1mol����
C.�ס������ʶ���ʹ������Ȼ�̼��Һ��ɫ
D.��������������ˮ�����֮һ���һ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�ᣨ��ͼ����һ���н�ѹ���õ�ҩ����ɿ����ᣨһ�ַ����ᣩ�������ͨ��������Ӧ�ϳɣ�����˵����ȷ���ǣ� �� 
A.��ԭ��ķ���ʽΪC16H20O9
B.��ԭ����ܺ���ˮ�����ӳɷ�Ӧ�����ܷ���ȡ����Ӧ
C.1 mol��������NaOH��Һ��Ӧ���������5molNaOH
D.������Ϳ����ᶼ����FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������NaCl��MgCl2��AlCl3��Һ�ֱ���������AgNO3��Һ��Ӧ�������ɵij��������ʵ���֮��Ϊ3�U2�U1����������������Һ�����ʵ���Ũ�ȱ�Ϊ�� ��
A. 1�U2�U3 B. 9�U6�U1 C. 3�U2�U1 D. 9�U3�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����Ȳ����ļӳɷ�Ӧ����ͬѧ��Ʋ�����������ʵ�飺��ȡһ�����Ĺ�ҵ�õ�ʯ��ˮ��Ӧ�������ɵ�����ͨ����ˮ�У�������Һ��ɫ����֤����Ȳ����ˮ�����˼ӳɷ�Ӧ��
��ͬѧ�����ڼ�ͬѧ��ʵ���У���ɫ�����Һ������������ɫ���ǣ��Ʋ����Ƶõ���Ȳ�л����ܺ���������ԭ�Ե��������塣�ɴ�����������ȳ�ȥ���ʣ�������ˮ��Ӧ����ش��������⣺
(1)д����ͬѧʵ����������Ҫ�Ļ�ѧ����ʽ��____________________��
(2)��ͬѧ��Ƶ�ʵ��________(��ܡ����ܡ�)��֤��Ȳ���巢���ӳɷ�Ӧ����������________��
a��ʹ��ˮ��ɫ�ķ�Ӧ��δ���Ǽӳɷ�Ӧ
b��ʹ��ˮ��ɫ�ķ�Ӧ�����Ǽӳɷ�Ӧ
c��ʹ��ˮ��ɫ�����ʣ�δ������Ȳ
d��ʹ��ˮ��ɫ�����ʣ�������Ȳ
(3)��ͬѧ�Ʋ����Ȳ�бض����е�һ������������___________��������ˮ��Ӧ�Ļ�ѧ����ʽ��___________________������֤�����б���ȫ����ȥ��
(4)����ѡ�������ĸ�װ��(����ͼ�����ظ�ʹ��)��ʵ����ͬѧ��ʵ�鷽���������ǵı�����뷽��д��װ�������ŵĻ�ѧҩƷ��
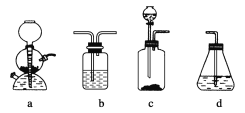

(5)Ϊ��֤��һ��Ӧ�Ǽӳɶ�����ȡ������ͬѧ�������pH��ֽ�����Է�Ӧ����Һ�����ԡ�������_________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com