
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
分析 根据热化学方程式的书写及其注意事项可知,需注明物质的聚集状态、△H的正负号、数值、单位,燃烧热抓住1mol可燃物燃烧生成稳定氧化物、中和热抓住生成1mol水,且利用燃烧与中和反应放热来解答.
解答 解:A、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故A错;
B、中和反应是放热反应,△H应小于0,故B错;
C、热化学方程式的书写注明了物质的聚集状态、△H的正负号、数值、单位,故C正确;
D、热化学反应方程式要注明物质在反应时的状态,故D错.
故选C.
点评 本题考查燃烧热以及热化学方程式的书写正误判断,重在搞清书写热化学方程式的注意事项.


科目:高中化学 来源: 题型:解答题
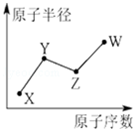 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: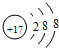 ;
;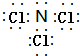 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
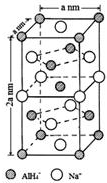 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
.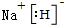 .
.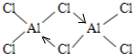 (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,增加反应物的量,必定加快反应速率 | |
| B. | 升高温度正反应速率增大,则逆反应速率也一定增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有1个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个H-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非极性分子中的原子一定无孤电子对 | |
| B. | 平面三角型分子一定是非极性分子 | |
| C. | 二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ | |
| D. | ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na<Mg<Al | D. | 还原性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com