
已知反应A(g) + 3B(g)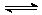 2C(g) + 2D(g),下列反应速率最大的是( )
2C(g) + 2D(g),下列反应速率最大的是( )
| A.v(D)=0.4 mol·L—1·s—1 | B.v (C)=0.5 mol·L—1·s—1 |
| C.v (B)=0.6 mol·L—1·s—1 | D.v (A)=0.15 mol·L—1·s—1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用某种仪器量取液体体积,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为 ( )。
A.量筒 B.容量瓶
C.滴定管 D. 以上均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行如下反应:N2+3H2 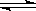 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
①平衡不发生移动;②平衡向正反应方向移动;③平衡向逆反应方向移动;
④NH3的质量分数增加;⑤正逆反应速率都增大。
A.①⑤ B.③④ C.②④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 升高温度 ,反应重新达平衡后,HCl的体积分数不变
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)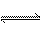 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分组成w(HI)=w(I2)
④反应速率v(H2)=v(I2)=1/2v(HI)时
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时
⑥温度和体积一定时,容器内压强不再变化
⑦温度和体积一定时,某一生成物浓度不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤ B.①④⑦ C.②⑦⑨ D.⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A+B(s) 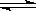 C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
| 物质 | X | Y | Z |
| 初始浓度/mol·L—1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L—1 | 0.05 | 0.05 | 0.1 |
 下列说法错误的是
下列说法错误的是

 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3 Y 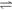 2 Z,其平衡常数为1600
2 Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质 ①烧碱、② Fe(OH)3胶体、③NaCl、④CO2、⑤铁片、⑥石墨、⑦甲烷、
⑧HNO3、⑨CaCO3,其中属于混合物的是(请填写序号,下同)______ ;属于酸的是______ ;属于酸性氧化物的是______;属于盐的是______;属于单质的是_____;属于非电解质的是______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com