
分析 ①加油站内有挥发的汽油的分子,拨打手机有静电;
②在煤矿巷道内有可燃性的气体甲烷等,明火照明可能会引发危险;
③闻气体的气味时,不能直接去闻,应用手轻轻在瓶口扇动,仅使极少量的气体飘进鼻孔,防止中毒;
④锌与稀硫酸一开始反应,放出的气体不纯,氢气里混有空气;
⑤浓硫酸溶于水时,放出大量的热,如果把水注入浓硫酸,会使液体沸腾溅出,损失浓硫酸,还可能伤人;
解答 解:①汽油为可燃物,遇静电火花,可能会发生爆炸,不符合安全要求,故①错误;
②甲烷、一氧化碳等可燃性的气体都有一定的爆炸极限,点燃可能发生爆炸,故不符合要求,故②错误;
③闻氨气的气味时,用手轻轻在瓶口扇动,仅使极少量的氨气飘进鼻孔,符合全操作要求,故③正确;
④一开始反应便收集气体,氢气不纯,做氢气点燃实验,会发生爆炸,不符合安全要求,故④错误;
⑤稀释浓硫酸时,沿烧杯内壁将硫酸缓缓加入水中,边加边搅拌,符合安全操作要求,故⑤正确;
根据分析可知,符合安全要求的为:③⑤,
故答案为:③⑤.
点评 本题考查了化学实验安全事故及其处理方法,题目难度不大,注意明确化学实验安全及事故处理方法,试题培养了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3S+6NaOH═2Na2S+Na2SO3+3H2O | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱比冷的纯碱去污能力强 | |
| B. | 红棕色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要过量的O2 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
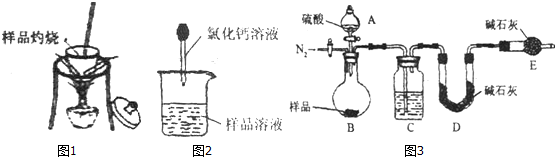
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 类别 | 单质 | 酸 | 碱 | 盐 | 氧化物 | 胶体 |
| 物质 | ⑥ | ① | ④ | ② | ⑤ | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
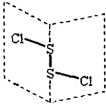 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为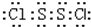 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
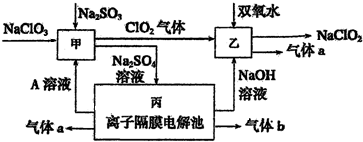
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com