
| A. | 30mL | B. | 55mL | C. | 65mL | D. | 175mL |
分析 100mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×1mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:100mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×1mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.05mol×3=0.15mol,
加入NaOH溶液的体积为$\frac{0.15mol}{2mol/L}$=0.075L,即为75mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3+OH-═AlO2-+2H2O
(0.1-0.05)mol 0.05mol
则消耗的碱的物质的量为0.3mol+0.05mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{2mol/L}$=0.175L,即为175mL,
故选:D.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
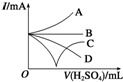 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶于1L 水所得的溶液 | |
| B. | 将0.5mol•L-1的NaNO3溶液100mL 加热蒸发掉50g水所得的溶液 | |
| C. | 将23g Na 溶于水并配成1L的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
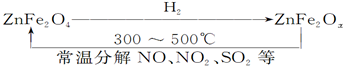
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除②外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第二周期第ⅦA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键 | |
| D. | A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
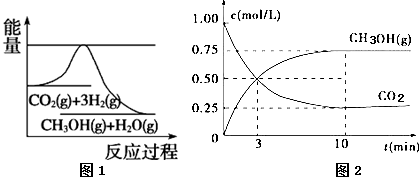
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 若有1mol电子转移,则氧化产物的物质的量是0.5mol | |
| C. | 据此反应原理,可以在酸性条件下用淀粉碘化钾试纸检验NO${\;}_{2}^{-}$的存在 | |
| D. | 若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g 质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA | |
| B. | 将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L | |
| C. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为7NA | |
| D. | 6g石英晶体中含有的Si-O键数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com