
|
向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液,使SO42-恰好完全反应,此时Al(OH)3的物质的量为 | |
| [ ] | |
A. |
1 mol |
B. |
1.33 mol |
C. |
1.67 mol |
D. |
0 |
科目:高中化学 来源:辽宁省沈阳二中2010-2011学年高二下学期期末考试化学试题 题型:022
某温度下,容积同为2 L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g)![]() H2(g)+I2(g);ΔH=+A kJ·mol-1;K=4.0)
H2(g)+I2(g);ΔH=+A kJ·mol-1;K=4.0)

(1)根据上表回答问题
①c1、c3的关系式为________
②a、b的关系式为________
③p2、p3的关系式为________
④α1与α2的关系式为________
(2)甲容器中:该反应的平衡常数表达式为________.
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟的平均反应速率为________mol·L-1·min-1(用含有c2的代数式表示)
(4)丙容器中:反应开始时进行的方向是________(填“向左”、“向右”或“不动”)
(5)乙容器中:当反应达到平衡状态后,向容器中再充入1 mol H2,则1分钟后,正反应速率与原平衡时相比________(填“增大”、“不变”或“减小”)
查看答案和解析>>
科目:高中化学 来源:江苏省上冈高级中学2011-2012学年高二下学期期中考试化学试题 题型:022
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)①温度降低时,K sp________(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:
Cr2O72-(4)欲使10 L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源:山东省济宁市金乡二中2011-2012学年高二下学期期中考试化学试题 题型:022
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①温度降低时,Ksp________(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(4)欲使10 L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源:江苏省扬州中学2011-2012学年高二下学期期中考试化学试卷 题型:022
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液的pH________(填大于、小于或等于)Na2A溶液的pH.
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①降低温度时,Ksp________(填“增大”、“减小”或“不变”).
②滴加少量浓盐酸,c(Ca2+)________(填“增大”、“减小”或“不变”).
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:
Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为:________.
(2)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(3)若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7? D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度?????????????????? B.降低温度
C.加入NH4Cl晶体??????????? D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
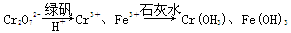
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com