
【题目】实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则物质的量浓度是( )
A.11.9 B.11.9 mol·L-1 C.0.012 mol·L-1 D.无法计算
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸480mL。
(1)选用的主要玻璃仪器有:
①_______,②_______,③_______,④______,⑤________。
(2)简要回答下列问题:所需浓硫酸的体积为_______mL(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,在一定条件下发生反应:2A(?)![]() B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是
A. 若正反应为吸热反应,则A为非气态
B. 若正反应为放热反应,则A为气态
C. 若在平衡体系中加入少量C,则该平衡不移动
D. 压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,1体积X2气体和3体积Y2气体化合生成2体积的气体化合物,则该气体化合物的化学式为 ( )
A. XY3 B. XY C. X3Y D. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。检测某工厂废液中含有大量Mg2+、Al3+、Cu2+、Ag+。试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是 (填序号);
A.SO![]() B.NO
B.NO![]() C.Cl
C.Cl![]() D.CO
D.CO![]()
(2)为检测废液中铝元素的含量需将其从废水样品中分离出来,所用的试剂是 ;其中镁元素发生变化的离子方程式是 ;
(3)为了回收废液中的金属银,某同学设计了如下方案:
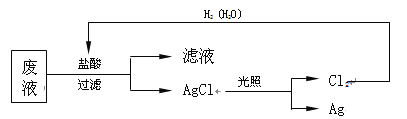
若该方案获得Ag 108 g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2的体积是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减 小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)
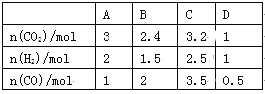
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述正确的是
A. 元素周期表中有七行,七个周期,有18列, 18个族
B. 目前使用的元素周期表中,同一主族的元素最外层电子数相同
C. 短周期元素是指1~20号元素,其中大多数为非金属
D. 元素周期表中,元素的种数与对应的原子种数一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
![]()
①平衡时,c(CH3OCH3)等于________ mol·L-1,反应混合物的总能量减少________ kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的浓度的曲线示意图。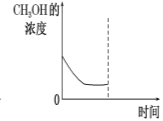
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+ CO(g)![]() CH3OH(g)
CH3OH(g)
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
![]()
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是 (填甲乙丙).

(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)=2CO2(g)K2
③H2O(g)=H2O(l)K3
④CH3OH(l)+O2(g)=CO(g)+2H2O(l)K4
则K4= (用含有K1,K2,K3的代数式表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com