
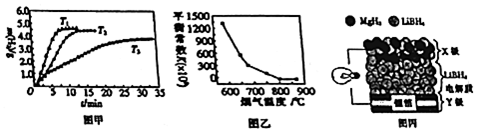
分析 (1)MgH2是一种离子化合物,镁失去最外层电子给氢原子;
(2)Mg2Cu在加压条件下与氢气生成MgH2和MgCu2,根据质量守恒可得;
(3)①已知:ⅠMgH2(s)?Mg(s)+H2(g)△H1=+74.4 KJ•mol-1;
ⅡH2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.8 KJ•mol-1;
ⅢMg(s)+$\frac{1}{2}$O2(g)═MgO(s)△H3=-141.6 KJ•mol-1
根据盖斯定律Ⅰ+Ⅱ+Ⅲ可得MgH2(s)+O2(g)=MgO(s)+H2O(g);
②MgH2作贮氢材料时,单位贮氢材料释放出氢气,反应为MgH2(s)?Mg(s)+H2(g)△H1=+74.4 KJ•mol-1,温度升高有利于氢气的释放;
(4)①根据平衡常数为生成物浓度幂之积与与反应物浓度幂之积之比可写,注意固体不写入;
②根据温度升高化学平衡向着吸热方向移动分析;
(5)全固态锂离子电池放电时电池反应为2Li+MgH2═Mg+2LiH,X极电极材料为MgH2,该极为正极,得电子,电极反应式为:MgH2+2Li++2e-=Mg+2LiH,则Y极为Li,作负极,电极反应式为:Li-e-=Li+,;充电时:Y极为阴极:反应式为:Li++e-=Li.
解答 解:(1)MgH2是一种离子化合物,镁失去最外层电子给氢原子,电子式为:[H:]-Mg2+[H:]-;
故答案为:[H:]-Mg2+[H:]-;
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,化学方程式为:2Mg2Cu+3H2=MgCu2+3MgH2;
故答案为:2Mg2Cu+3H2=MgCu2+3MgH2;
(3)①已知:ⅠMgH2(s)?Mg(s)+H2(g)△H1=+74.4 KJ•mol-1;
ⅡH2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-241.8 KJ•mol-1;
ⅢMg(s)+$\frac{1}{2}$O2(g)═MgO(s)△H3=-141.6 KJ•mol-1
根据盖斯定律Ⅰ+Ⅱ+Ⅲ可得MgH2(s)+O2(g)=MgO(s)+H2O(g)△H=-309 kJ•mol-1;
故答案为:MgH2(s)+O2(g)=MgO(s)+H2O(g)△H=-309 kJ•mol-1;
②MgH2作贮氢材料时,单位贮氢材料释放出氢气,反应为MgH2(s)?Mg(s)+H2(g)△H1=+74.4 KJ•mol-1,温度升高有利于氢气的释放,由图可知,T1、T2、T3氢气的释放速率减慢,则T3<T2<T1;
故答案为:T3<T2<T1;
(4)①反应2MgO(s)+2SO2 (g)+2NO(g)?2MgSO4(s)+N2(g),化学平衡常数K=$\frac{c({N}_{2})}{{c}^{2}(S{O}_{2})•{c}^{2}(NO)}$;
故答案为:$\frac{c({N}_{2})}{{c}^{2}(S{O}_{2})•{c}^{2}(NO)}$;
②温度升高化学平衡向着吸热方向移动,由图可知温度升高,K减小,说明该反应为放热反应,则△H=a KJ•mol-1<0;
故答案为:<;
(5)全固态锂离子电池放电时电池反应为2Li+MgH2═Mg+2LiH,X极电极材料为MgH2,该极为正极,得电子,电极反应式为:MgH2+2Li++2e-=Mg+2LiH,则Y极为Li,作负极,电极反应式为:Li-e-=Li+,;充电时:Y极为阴极:反应式为:Li++e-=Li;
故答案为:MgH2+2Li++2e-=Mg+2LiH;Li++e-=Li.
点评 本题考查了物质的制备、盖斯定律、原电池的工作原理、温度对化学平衡、化学平衡常数的影响以及平衡的判断,难度中等,考查学生分析和解决问题的能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
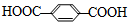 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )| A. | 合成涤纶的反应为加聚反应 | |
| B. | 对苯二甲酸和苯甲酸互为同系物 | |
| C. | 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH | |
| D. | 涤纶的结构简式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
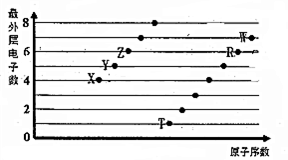 部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题:
部分短周期元素原子最外层电子数与原子序数的关系如图,回答下列问题: ;已知1mol XZW2与4mol NaOH
;已知1mol XZW2与4mol NaOH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com