
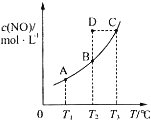
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
分析 A、由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆移;
B、化学平衡常数只受温度影响,升高温度平衡向吸热反应移动,根据平衡移动判断温度对平衡常数的影响分析;
C、由图可知,T2时反应进行到状态D,c(CO)高于平衡浓度,故反应向逆反应进行;
D、达到平衡状态时,压强和温度成正比例关系.
解答 解:A、由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆移,所以正反应为放热反应,即Q>0,故A正确;
B、该反应正反应是放热反应,升高温度平衡向逆反应移动,所以升温化学平衡常数减小,故K1>K2,故B错误;
C、T2时反应进行到状态D,c(NO)高于平衡浓度,故反应向正反应进行,则一定有υ(正)>υ(逆),故C正确;
D、达到平衡状态时,压强和温度成正比例关系,则PB=PD<PC,故D错误.
故选AC.
点评 本题以化学平衡图象为载体,考查温度对平衡移动的影响、对化学平衡常数的影响等,难度中等,注意曲线的各点都处于平衡状态.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
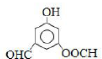 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
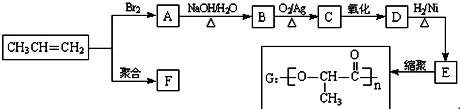
 +2H2O.
+2H2O. .
.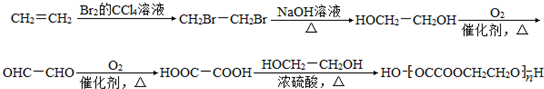 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
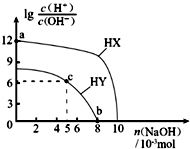 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
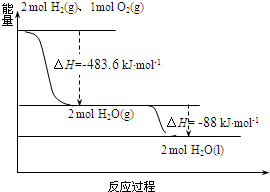
| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
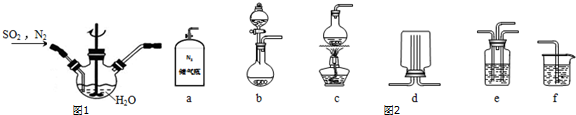
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO3中含3NA个氧原子 | |
| B. | 标准状况下,22.4LCH2Cl2含有2NA氯原子 | |
| C. | 1molSO2与足量的H2S充分反应,转移NA个电子 | |
| D. | 16gCH4中含有10NA个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com