
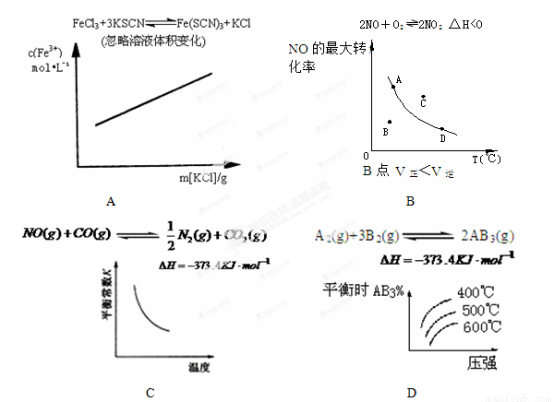
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷(解析版) 题型:选择题
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
A.IF5 + 3H2O = HIO3 +5HF
B.3IBr +2Fe = FeI3 + FeBr3
C.BrCl的氧化性强于I2
D.IBr可以与NaOH溶液反应生成2种盐
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:填空题
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
① 根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:

① 求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1 ~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:选择题
下列陈述Ⅰ和Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:填空题
利用“化学蒸气转移法”制备TaS2晶体,某温度下的2L恒容密闭容器中加入一定量 的 I2(g)和TaS2(s)发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H=a kJ·mol-1 (I)
TaI4(g)+S2(g)△H=a kJ·mol-1 (I)
达平衡时,TaS2(s)、I2(g)、TaI4(g)、、S2(g)的物质的量分别为3 mol 、2mol、2mol、2mol。
(1)反应(I)的平衡常数表达式K=
(2)若该温度下该容器中某时刻TaS2(s)、I2(g)、TaI4(g)、、S2(g)的物质的量分别为2mol、2mol、4mol、4mol,则该时刻平衡向 (填“正反应”或“逆反应”)移动,v正 v逆(填“>”、“=”或“<”)。
(3)在不同温度下,该反应的平衡常数K如下表:
温度/℃ | 40 | 80 | 200 |
平衡常数K | 1 | 1.5 | 4 |
该反应的△H 0(填“>”、“=”或“<”)。
(4)40℃时,向该恒容密闭容器中加入2mol I2(g)和4mol TaS2(s),I2(g)的平衡转化率为 (写出计算过程,结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中,能证明某物质是强电解质或弱电解质的是
A.某物质熔化时不导电,则该物质为弱电解质
B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质
C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸
D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质
查看答案和解析>>
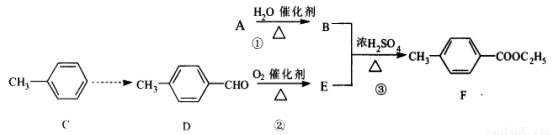
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:推断题
(16分)有机物F是合成药物的中间体。可利用中学所学的有机物进行合成,其方案如下:
A的产量标志着一个国家石油化工发展水平。
(1) D的分子式是 ,1mol D完全燃烧需消耗 mol O2
(2)反应①的化学反应方程式是 ;该反应的反应类型是 。在食品工业中E及其钠盐都可用作 剂。
(3)写出反应③的化学反应方程式: 。
(4)写出符合下列条件的E的同分异构体: 。(只答其中一种即可)
ⅰ含有苯环;ⅱ能够发生银镜反应;ⅲ能发生水解反应且水解产物与FeCl 3溶液显紫色
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
能说明M的非金属性比N强的事实是
A.M的气态氢化物比N的气态氢化物稳定
B.HxM的酸性比HyN的酸性强
C.单质M的熔沸点比单质N的溶沸点高
D.M能将N从它的盐溶液中置换出来
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
下列实验操作能达到预期实验目的的是
| 实验目的 | 实验操作 |
A | 鉴别Al3+和Fe3+ | 分别加入过量NaOH溶液 |
B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com