
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是______,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
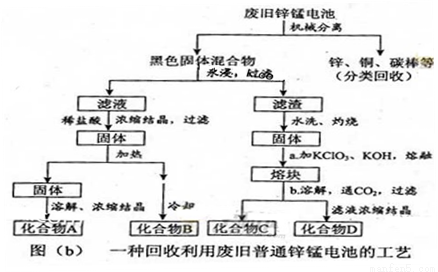
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 。(填化学式)
(1)①Zn NH4Cl MnO2+NH4++e-=MnOOH+NH3
②碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)①ZnCl2;NH4Cl②3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-③H2
【解析】 (1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,锌是负极材料,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+ NH3。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)废电池经机械分离后,加水溶解后再加稀盐酸,浓缩结晶得到氯化铵和氯化锌。氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌。绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-。采用惰性电极电解K2MnO4溶液,阴极氢离子得电子生成氢气。


科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
下列图示中能较长时间看到Fe(OH)2白色沉淀的有



A.Ⅰ、Ⅱ、Ⅳ
B.Ⅰ、Ⅱ、III、Ⅳ、Ⅵ
C.Ⅰ、III、Ⅴ
D.Ⅰ、Ⅱ、III、Ⅳ、Ⅴ、Ⅵ
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的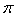 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:
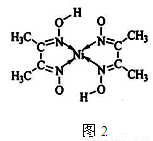
①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为: .其电极均由石墨材料做成,则电解时不断消耗的电极是 ;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 ;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为 ,正极附近溶液的pH (填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
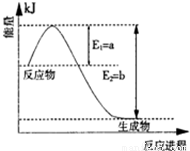
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程: (△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,
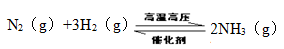
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ、铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:

有3mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 … |
In/kJ.mol-1 578 1817 2745 11578 … |
则该元素是 (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 ,Ge的最高价氯化物分子式是 ,该元素可能的性质或应用有 ;
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物 ,下列叙述正确的有
,下列叙述正确的有
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点  的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
近年来,冠以绿色的新概念不断产生,如绿色食品、绿色能源、绿色化学等,绿色化学要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行且符合“绿色化学”要求方案的是
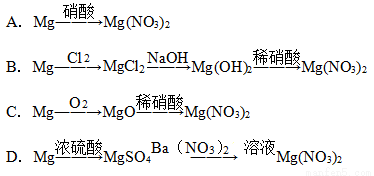
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++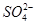 =BaSO4↓
=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH-+2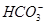 =CaCO3↓+
=CaCO3↓+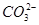 +2H2O
+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸: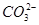 +H+=
+H+=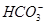
A.①②⑤ B.②③④⑤⑧ C.④⑤⑥⑦ D.②③⑧
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是

①CO2+OH-=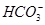 ②CO2+2OH-=
②CO2+2OH-=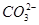 +H2O
+H2O
③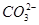 +Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2
+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2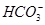
⑤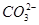 +CO2+H2O=2
+CO2+H2O=2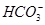
A.③① B.②⑤ C.⑤④ D.④②
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
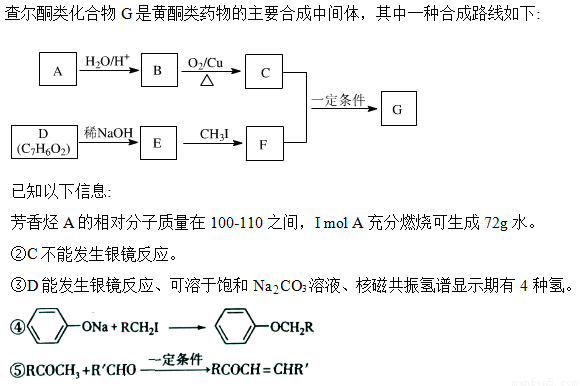
回答下列问题:
(1)A的化学名称为____________。
(2)由B生成C的化学方程式为____________________。
(3)E的分子式为________________,由E生成F的反应类型为________。
(4)G的结构简式为____________________。
(5)D的芳香同分异构体H既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有_______种,其中核磁共振氢谱为5组峰,且峰面积为2:2:2:1:1的为________________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com