
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
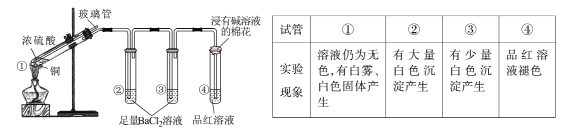
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
【答案】B
【解析】
实验探究铜与浓硫酸的反应,装置1为发生装置,溶液仍为无色,原因可能是混合体系中水太少,无法电离出铜离子,有白雾说明有气体液化的过程,同时产生白色固体,该固体可能是无水硫酸铜;试管2、3中有白色沉淀生成,该沉淀应为硫酸钡,说明反应过程有SO3生成或者硫酸挥发,3中沉淀较少,说明三氧化硫或挥发出的硫酸消耗完全;试管4中品红褪色说明反应中生成二氧化硫,浸有碱的棉花可以处理尾气,据此分析作答。
A. 二氧化硫不与氯化钡反应,白色沉淀不可能是BaSO3,故A错误;
B. 根据分析可知①中可能有部分硫酸挥发了,故B正确;
C. 冷却后的试管中仍有浓硫酸剩余,浓硫酸稀释放热,不能将水注入试管,会暴沸发生危险,故C错误;
D. 反应过程中SO3可能是氧气将二氧化硫氧化生成,若先往装置内通入足量N2,体系内没有氧气,则无SO3生成,试管2、3中将无沉淀产生,实验现象发生变化,故D错误;
故答案为B。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】(1)常用垃圾处理方法有三种:
①________法,可以产生大量肥料;
②________法,可以避免露天堆放产生的问题;
③_____法,可以使垃圾体积缩小,能彻底消灭病原体以及产生热量等优点。
(2)回收利用垃圾资源是现代生活不可忽视的重要活动。请举出生活垃圾回收利用的一个事例:_________。
(3)回收利用垃圾,首先要对垃圾进行分类,一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标志的垃圾回收箱,结果却发现有许多居民并没有分类放置。造成这种现象的原因可能是________。
A.居民嫌麻烦,没有垃圾分类的习惯 B.居民每天产生的垃圾量非常多
C.居民的环保意识不强 D.居民不清楚垃圾分类的标准
(4)
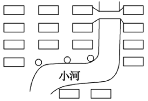
上图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的两个问题是_________和________。垃圾收集点选址应考虑的因素包括(提出三点)________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:

实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
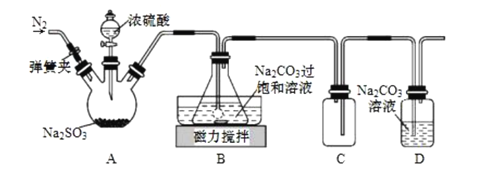
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分解:Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g) ![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1<p2 m+n>p放热反应
B.T1>T2 p1<p2 m+n<p吸热反应
C.T1<T2 p1>p2 m+n>p放热反应
D.T1>T2 p1<p2 m+n>p吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
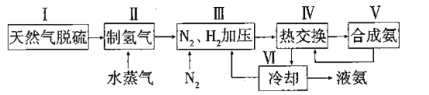
(1)步骤II中制氯气原理如下:
I.![]() △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II.![]() △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
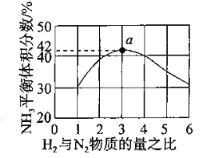
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
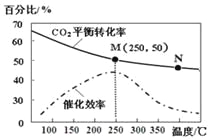
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_____区;第二周期元素中,第一电离能比氧大的有_____种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_____;其分子的VSEPR模型为_____,与其互为等电子体的离子为_____(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_____。
(4)氧元素可与Fe形成低价态氧化物FeO。FeO立方晶胞结构如图所示,则Fe2+的配位数为_____;与O2-紧邻的所有Fe2+构成的几何构型为_____。
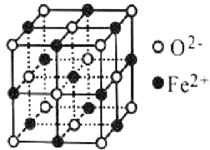
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com