
分析 根据有机物A的蒸气与空气的相对密度是1.6计算A的相对分子质量,根据质量守恒定律判断3g有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式,此有机物可以与Na发生置换反应,说明含有羟基,以此解答.
解答 解:n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
该化合物的蒸气与空气的相对密度是1.6,则有机物A的相对分子质量=29×1.6=46,有机物A中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以该有机物的最简式为C2H6O,而C2H6O的相对分子质量为46,所以该有机物的分子式为C2H6O,
此有机物可以与Na发生置换反应,说明含有羟基,应为乙醇,有机物与乙酸发生酯化反应的方程式为2C2H5OH+2Na=2C2H5ONa+H2↑,
故答案为:2C2H5OH+2Na=2C2H5ONa+H2↑.
点评 本题考查了有机物分子式的计算,题目难度不大,注意掌握确定有机物分子式、结构简式的方法,明确气体的密度与气体摩尔质量之间的关系是解答本题的关键.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关 | |
| B. | 在任何条件下,化学平衡常数都是一个定值 | |
| C. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度 | |
| D. | 从平衡常数大小可以推断一个反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
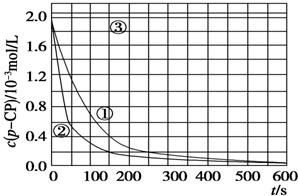 [数据处理]
[数据处理]查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
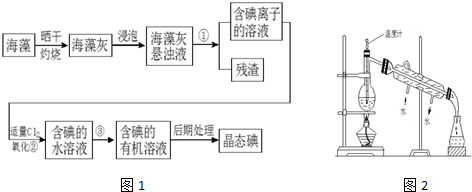
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
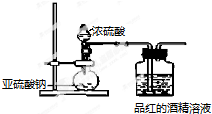
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com