
【题目】能源可分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需要依靠其它能源的能量间接制取的能源称为二级能源。根据上面的叙述回答,下列叙述正确的是( )
A.电能是二级能源
B.水力是二级能源
C.天然气是二级能源
D.焦炉气是一级能源
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.钠具有强还原性,可用于制作高压钠灯
B.活性炭具有吸附性,可用于吸附水中的杂质
C.Al2O3是两性氧化物,可用作耐高温材料
D.明矾易溶于水,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅的叙述中,正确的是( )
A. 二氧化硅可用于光导纤维,利用了它的导电性
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态形式存在
D. 硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
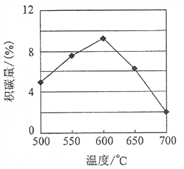
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
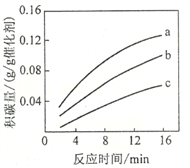
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验(夹持仪器省略)。将液体A逐滴加入到固体B中,回答下列问题:

(1)图中盛放液体A的仪器名称为_________________,D装置在实验中的作用是_______________________。
(2)若A为浓盐酸,B为KMnO4,C中盛有KI-淀粉溶液,旋开E后,C中的现象为____________;C中发生反应的离子方程式为__________;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式: ______。
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是__________,C中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上氦元素主要以4He形式存在,月球上氦元素主要以3He形式存在,已知一个12C原子的质量为a g,一个3He 原子的质量为b g,一个4He 原子的质量为c g。下列说法正确的是( )
A. 3He的电子式为:![]()
B. 3He的相对原子质量约为bNA,氦元素的相对原子质量为![]()
C. 3He、4He为氦元素的同素异形体,同温同压下,密度之比为c∶b
D. 3He、4He为氦元素的同位素,同温同压下,等体积的质量之比为b∶c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com