(2011?枣庄模拟)由Fe
2O
3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
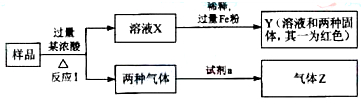
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成.取上层清液,通入CO
2,无明显变化,说明样品中不含有的物质是
Al
Al
.(填化学式)
(2)如何检验Y中的金属阳离子
取少量Y中的溶液加入适量KSCN溶液,无明显现象,再滴入适量氯水,溶液呈血红色,则说明溶液中含有Fe2+
取少量Y中的溶液加入适量KSCN溶液,无明显现象,再滴入适量氯水,溶液呈血红色,则说明溶液中含有Fe2+
.
(3)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO
3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是
C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O
C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O
.
②若Z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是
NO、CO2
NO、CO2
.
(4)向Y中通入过量的Cl
2,并不断搅拌,充分反应后,溶液中的阳离子是
Cu2+、Fe3+、H+
Cu2+、Fe3+、H+
_.(填写离子符号)
(5)取Y中的溶液,调节pH约为7,加入淀粉KI和H
2O
2,溶液呈蓝色并有红褐色沉淀生成.当消耗2molI
-时,共转移3mol电子,该反应的离子方程式
2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2
2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2
.




 2SO3(g)△H=-196.6KJ?mol- 1)
2SO3(g)△H=-196.6KJ?mol- 1)