
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
分析 若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,当速率与浓度变化成正比时,需要10s,但浓度越小,化学反应速率越小,需要的时间就长,以此来解答.
解答 解:若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;
c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,
当速率与浓度变化成正比时,需要$\frac{0.02mol/L}{0.03mol/L}$×15s=10s,
但浓度越小,化学反应速率越小,需要的时间就长,
所以需要时间大于10s,
故选B.
点评 本题考查影响化学反应速率的因素,注意浓度越大反应速率越大是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
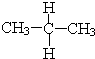 与
与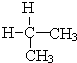 ⑦CH3CH3与
⑦CH3CH3与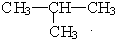
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: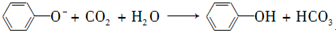 - - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com