
| A. | K+、I-、AlO2-、MnO4- | B. | Na+、S2-、NO3-、SO42- | ||
| C. | Al3+、NH4+、NO3-、F- | D. | K+、Cl-、ClO-、CO32- |
分析 溶液能使红色的石蕊试纸先变蓝色后褪色,则溶液显碱性,且具有强氧化性,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:溶液能使红色的石蕊试纸先变蓝色后褪色,则溶液显碱性,且具有强氧化性,
A.I-、MnO4-发生氧化还原反应不能共存,故A不选;
B.溶液中不能存在还原性离子S2-,故B不选;
C.碱性溶液中不能大量存在Al3+、NH4+,故C不选;
D.碱性溶液中该组离子之间不反应,可大量共存,且含ClO-能使溶液褪色,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| B. | 在标准状况下,22.4L空气中含有NA个单质分子 | |
| C. | 在18g18O2中含有NA个氧原子 | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ③④⑤⑥ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中,反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为2Al3++3CO32-═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+ | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内NO2的生成速率为2.96×10-3 mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
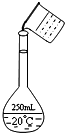 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com