
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 1 L pH=1的硫酸溶液中含有的H+数为0.2NA | |
| C. | 由1 mol NH4Cl和少量氨水形成的中性溶液中,NH4+数目小于NA个 | |
| D. | 在标准状况下,2.24L的C12溶于水,充分反应后转移电子数一定为0.1NA |
分析 A、石墨和C60均由碳原子构成;
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
C、由1 mol NH4Cl和少量氨水形成的中性溶液中,存在电荷守恒:n(NH4+)+n(H+)=n(OH-)+n(Cl-);
D、氯气和水的反应为可逆反应.
解答 解:A、石墨和C60均由碳原子构成,故12g混合物中含有1mol碳原子,则含6NA个质子,故A正确;
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故1L溶液中含有的氢离子的个数为0.1NA个,故B错误;
C、由1 mol NH4Cl和少量氨水形成的中性溶液中,存在电荷守恒:n(NH4+)+n(H+)=n(OH-)+n(Cl-),而溶液显中性,故有n(H+)=n(OH-),则有n(NH4+)=n(Cl-)=1mol,故溶液中的铵根离子的个数为NA个,故C错误;
D、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.
氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
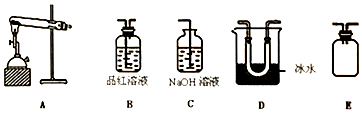
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油和鸡蛋清水解都能生成氨基酸 | |
| B. | 乙酸乙酯与乙烯在一定条件下都能与水发生加成反应 | |
| C. | 丙烯分子中最多有8个原子共平面 | |
| D. | 用碳酸钠溶液可以区分乙醇、乙酸、苯和硝基苯四种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
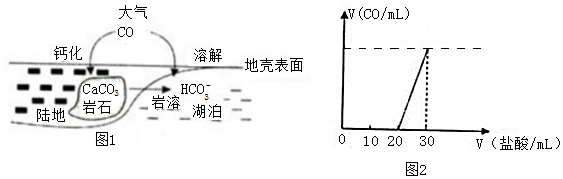
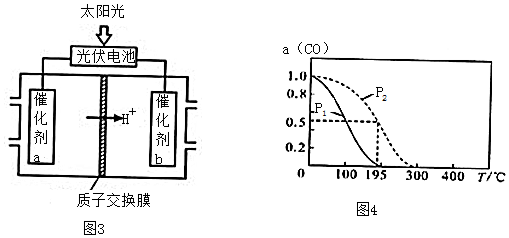
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 1:5 | C. | 6:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的物质的量 | B. | CO32-的物质的量 | C. | c(HCO3-) | D. | 由水电离的 c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 | |
| B. | 浓HNO3见光易分解,所以应保存在棕色试剂瓶中 | |
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| D. | 常温下,向浓⑤中投入Fe片,无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com