
 (2)合成氨的反应原理为:
(2)合成氨的反应原理为:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol H2、2molN2 | 4mol H2、4molN2 | 2mol NH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| 平衡时N2的体积分数 | w1 | W2 | W3 |
| 混合气体的密度(g•L-1) | ρ1 | ρ2 | ρ3 |
分析 (1)由 可知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-aKJ•mol;②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-bKJ•mol;③C5H12(g)+8O2(g)=5CO2(g)+6H2O(g)△H=-cKJ•mol,由盖斯定律可知
可知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-aKJ•mol;②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-bKJ•mol;③C5H12(g)+8O2(g)=5CO2(g)+6H2O(g)△H=-cKJ•mol,由盖斯定律可知
C5H12(g)+5H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)△H=5①+11②-③;
(2)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,结合反应的特点进行分析;
②3H2(g)+N2(g) $?_{催化剂}^{高温高压}$2NH3(g)
初起(mol•L-1):2 2 0
变化(mol•L-1):1.5 0.5 1
平衡(mol•L-1):0.5 1.5 1
根据v=$\frac{△c}{△t}$计算,平衡常数等于平衡时生成物浓度幂之积比上反应物浓度幂之积;
③a.丙相当在甲的基础上减少氢气,平衡逆向移动,氮气的浓度增大,所以cl>c3;
b.乙相当在甲基础上增大压强,平衡正向移动,所以wl>w2;
c.根据ρ=$\frac{m}{V}$,体积相同,气体的质量越大密度越大,m乙>m甲>m丙,所以ρ2>ρ1>ρ3;
(3)将产物混合气中的氨冷却分离后,剩余气体循环使用,也可以使平衡正向移动,提高反应物的利用率.
解答 解:(1)由 可知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-aKJ•mol;②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-bKJ•mol;③C5H12(g)+8O2(g)=5CO2(g)+6H2O(g)△H=-cKJ•mol,由盖斯定律可知
可知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-aKJ•mol;②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-bKJ•mol;③C5H12(g)+8O2(g)=5CO2(g)+6H2O(g)△H=-cKJ•mol,由盖斯定律可知
C5H12(g)+5H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)△H=5①+11②-③=c-5a-11b,故答案为:c-5a-11b;
(2)①a.容器内混合气体的密度一直保持不变,不能作平衡的标志,故选;
b.3v正(N2)=v正(H2)═v逆(H2),达平衡状态,故不选;
c.容器内混合气体的平均相对分子质量保持不变,说明气体的物质的量不变,反应达平衡状态,故不选;故选a;
②3H2(g)+N2(g) $?_{催化剂}^{高温高压}$2NH3(g)
初起(mol•L-1):2 2 0
变化(mol•L-1):1.5 0.5 1
平衡(mol•L-1):0.5 1.5 1
根据v(NH3)=$\frac{△c}{△t}$=$\frac{1mol•{L}^{-1}}{20min}$=0.05mol•L-1•min-1,
K=$\frac{{1}^{2}}{0.{5}^{3}×1.5}$=5.33,故答案为:0.05mol•L-1•min-1,5.33;
③a.丙相当在甲的基础上减少氢气,平衡逆向移动,氮气的浓度增大,所以cl>c3,故正确;
b.乙相当在甲基础上增大压强,平衡正向移动,所以wl>w2,故错误;
c.根据ρ=$\frac{m}{V}$,体积相同,气体的质量越大密度越大,m乙>m甲>m丙,所以ρ2>ρ1>ρ3,故正确;
故选ac;
(3)将产物混合气中的氨冷却分离后,剩余气体循环使用,也可以使平衡正向移动,提高反应物的利用率,故答案为:将产物混合气中的氨冷却分离后,剩余气体循环使用.
点评 本题考查学生盖斯定律的应用、化学平衡移动及平衡常数与计算、合成氨条件的选择等,难度中等,关键是三行式的应用,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | HCl+AgNO3═AgCl+HNO3 | B. | MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O | ||
| C. | 2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | D. | Mg+2HCl═MgCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在Kw/c(OH-)=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1 mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | |||
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 向盛有Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色退去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 向盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性和酸性 |
| D | 向浓度均为KCl、KI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
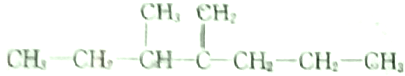 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯 ,可命名为1-甲基-3-乙基苯.
,可命名为1-甲基-3-乙基苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com