
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下: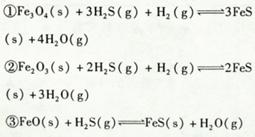
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是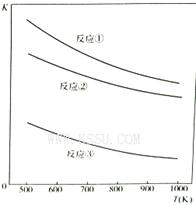
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
B
解析试题分析:A. 在反应①中Fe3O4作氧化剂,H2作还原剂;在反应②中Fe2O3作氧化剂,H2作还原剂;在反应③中发生的是复分解反应。错误。B.由温度与上述各反应的平衡常数的关系图示可以看出:升高温度,个反应的化学平衡常数减小。说明升高温度梦幻西游平衡向逆反应方向移动,根据平衡一定原理:升高温度,化学平衡向吸热反应方向移动,你反应方向为吸热反应,所以反应①、②、③的正反应都是放热反应。正确。C. 如果要使H2S的的脱除率升高,应该使化学平衡向正反应方向移动。由于这些反应的正反应都是放热反应,所以应该是降低温度,平衡才能正向移动。因此反应①、②、③中,温度越低H2S的的脱除率越高。错误。D. 这几个反应在反应前后气体的体积相等,所以改变压强,化学平衡不发生移动,H2S脱除率不变。错误。
考点:考查氧化还原反应的确定及氧化剂、还原剂的概念、反应的热效应、温度、压强对化学平衡的影响的知识。


科目:高中化学 来源: 题型:单选题
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是
| A.2F2+2H2O=4HF+O2↑ | B.C+H2O CO+H2 CO+H2 |
| C.2Na+2H2O=2NaOH+H2↑ | D.3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既属于氧化还原反应,又是吸热反应的是
| A.灼热的碳与CO2的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.铝片与稀盐酸的反应 | D.甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有下列三个反应:
①Cl2+FeI2 FeCl2+I2
FeCl2+I2
②2Fe2++Br2 2Fe3++2Br-
2Fe3++2Br-
③Co2O3+6HCl 2CoCl2+Cl2↑+3H2O,
2CoCl2+Cl2↑+3H2O,
下列说法中正确的是( )
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 |
D.根据反应①②一定可以推理得到Cl2+FeBr2 FeCl2+Br2 FeCl2+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知氧化性:Cl2>IO3—>Fe3+>I2,以下实验的结论或实验的预测合理的是( )
| A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I- |
| B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色 |
| C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有IO3— |
| D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,则下列说法不正确的是
( )
| A.Cl2是该反应的氧化产物 |
| B.氧化剂和被氧化的还原剂的物质的量之比为1∶14 |
| C.当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol |
| D.由该反应可知还原性:HCl>CrCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com