
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
分析 ①乙醇和水互溶,但沸点不同;
②色谱分离法,它利用各成分对同一吸附剂吸附能力不同,使在移动相(溶剂)流过固定相(吸附剂)的过程中,连续的产生吸附、解吸附、再吸附、再解吸附,从而达到各成分的互相分离的目的,色素溶于有机溶剂;
③碘易升华;
④苯甲酸中杂质的溶解度很小或很大,可以根据溶解度的差异进行分离;
⑤苯和溴苯不分层.
解答 解:①乙醇和水互溶,但沸点不同,可利用蒸馏法分离,故正确;
②色素易溶于有机溶剂,可用色谱法分离菠菜叶中的色素,故正确;
③混合物中只有碘易升华,用升华法可分离碘和砂子的混合物,故正确;
④苯甲酸中杂质的溶解度很小或很大,可以根据溶解度的差异进行分离,则用重结晶法提纯苯甲酸,故正确;
⑤苯和溴苯不分层,不能利用分液法分离,故错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同分异构体因结构不同,化学性质一定差别很大 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 同分异构体不可能互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互为同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核内的中子数与核外电子数之差为32 | |
| C. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 | |
| D. | 1 mol KHSO4加热熔化可电离出2NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
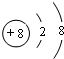 ,D元素在周期表中的位置是第三周期ⅥA族.
,D元素在周期表中的位置是第三周期ⅥA族.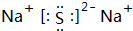 ,氢化物的稳定性是A>D(填“>”或“<”).
,氢化物的稳定性是A>D(填“>”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com