
 X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:| 6-1×2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:H2O>H2S;CH4<SiH4 |
| B、酸性:HNO2<HNO3;H3PO4<H2SO4 |
| C、还原性:H2S>HI>HBr>HCl |
| D、键长:C-H<N-H<O-H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| W | Y |
| Y的氢化物 | 一元酸HA |
| Ka1=9.1×10-8,Ka2=1.1×10-12 | Ka=1.1×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
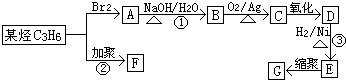
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com