
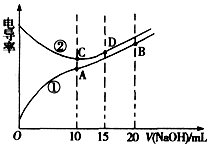
| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
分析 A.浓度相同的醋酸和盐酸,醋酸电离程度小于盐酸,则c(H+)盐酸大于醋酸,c(H+)越大溶液导电性越强;
B.A点醋酸和NaOH恰好完全反应生成醋酸钠,溶液中存在电荷守恒,根据电荷守恒判断;
C.相同温度下,A点溶液中溶质为醋酸钠、B点溶液中溶质为等物质的量浓度的醋酸和醋酸钠、C点溶液中溶质为NaCl,酸或碱抑制水电离,含有弱离子的盐促进水电离;
D.D点溶液中溶质为NaCl和NaOH,且c(NaCl)=2c(NaOH),溶液中存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断.
解答 解:A.浓度相同的醋酸和盐酸,醋酸电离程度小于盐酸,则c(H+)盐酸大于醋酸,c(H+)越大溶液导电性越强,所以相同浓度的盐酸和醋酸,盐酸导电性大于醋酸,根据图知导电性①<②,所以①代表滴定CH3COOH溶液的曲线,故A正确;
B.A点醋酸和NaOH恰好完全反应生成醋酸钠,溶液中存在电荷守恒c(CH3COO-)+c(OH-)-c(H+)=c(Na+),二者等体积混合时c(Na+)是原来的一半,所以A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1,故B正确;
C.相同温度下,A点溶液中溶质为醋酸钠、B点溶液中溶质为等物质的量浓度的醋酸和醋酸钠、C点溶液中溶质为NaCl,酸或碱抑制水电离,含有弱离子的盐促进水电离,所以B点抑制水电离、A点促进水电离、C点不促进也不抑制水电离,则在相同温度下,A、B、C三点溶液中水电离的c(H+):B<C<A,故C错误;
D.D点溶液中溶质为NaCl和NaOH,且c(NaCl)=2c(NaOH),溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),根据物料守恒得3c(Cl-)=2c(Na+),所以得c(Cl-)=2c(OH-)-2c(H+),故D正确;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、判断能力,明确各点溶质成分及其性质是解本题关键,灵活运用守恒思想分析解答即可,注意D点溶液中溶质量的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液一定呈酸性 | |
| B. | c(H+)水电离产生=c(OH-)水电离产生的溶液一定呈中性 | |
| C. | 使石蕊试液显红色的溶液一定呈酸性 | |
| D. | 强酸和强碱等物质的量混合后溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
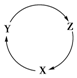 下列各组物质中,满足如图物质一步转化关系的选项是( )
下列各组物质中,满足如图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | S | SO2 | SO3 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向纯水中加入少量氢氧化钠固体,c(H+)减小,Kw不变 | |
| D. | 向纯水中加入盐酸,将抑制水的电离,Kw变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
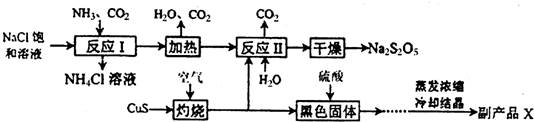
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com