
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01molL-1HA的溶液中逐滴加入0.02molL-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01molL-1HA溶液中由水电离出的c(H+)=______molL-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____molL-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100molL—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________。
【答案】1×10—12 < M++H2OH++MOH c(A—)>c(H+)>c(M+) 0.005 < 1×10—4.2
【解析】
(1)①在滴加碱液前0.01molL-1HA的溶液pH=2,说明HA是强酸,强酸中的OH-完全由水电离提供;
②从图中看出,加入MOH溶液51mL溶液才呈中性,说明MOH是弱碱。如果MOH是强碱,中和至中性时需要MOH的体积应刚好为50mL。所以MA是强酸弱碱盐,其水解使溶液显碱性;
③通过计算和估算得出数值,直接进行浓度大小的比较;
④K点时,相当于MA和MOH以1:1混合。据电荷守恒进行计算。
⑵①从图可以Q点是H2C2O4和C2O42-两微粒的交点,从图上明显看出HC2O4-物质的量分数大,折算成浓度也有:c(H2C2O4)<c(HC2O4—);
②利用电离平衡常数的定义式直接进行求算。
(1)①在滴加碱液前0.01molL-1HA的溶液pH=2,说明HA是强酸;强酸溶液中的OH-全部由水电离提供,所以常温下,0.01molL-1HA溶液中由水电离出的c(H+)=1×10-12molL-1;
②从图中看出,加入MOH溶液51mL溶液才呈中性,说明MOH是弱碱。如果MOH是强碱,中和至中性时需要MOH的体积应刚好为50mL。所以MA是强酸弱碱盐,其水解使溶液显碱性,所以MA溶液的pH>7,水解的离子方程式为:M++H2O![]() MOH+H+;
MOH+H+;
③X点时可看作酸被中和掉约一半的点,相当于HA和MA以1:1时混合,此时c(A-)=0.008mol/L,M+水解是很微弱的,所以c(M+)≈0.004mol/L,此时c(H+)比0.01mol/L略小一点点,因此该溶液中离子浓度由大到小的顺序:c(A-)> c(H+)>c(M+);
④K点时,相当于MA和MOH以1:1混合。据电荷守恒有:c(H+)+c(M+)=c(OH-)+c(A-),变形得:c(H+)+c(M+)-c(OH-)=c(A-)=![]() =0.005mol/L;
=0.005mol/L;
(2)①从图可以Q点是H2C2O4和C2O42-两微粒的交点,从图上明显看出c(H2C2O4)<c(HC2O4—);
②取交点P来计算该温度下HC2O4-的电离平衡常数。![]() =1×10-4.2。
=1×10-4.2。


科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为__________。
(2)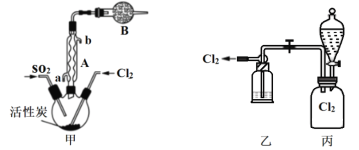
①仪器A的名称为___________,装置B的作用是____________。
②装置乙中装入的试剂是浓硫酸,装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 molL1浓盐酸 C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL 0.5000mol·L1 NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL滴定终点的判断为___________,产品的纯度为_________。
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。

①加热时A中试管出现黄绿色,装置B的作用是_________。
②装置C中反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
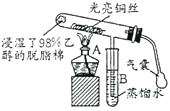
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称,下列有关![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 和
和![]() 原子中均含有22个质子B.
原子中均含有22个质子B.![]() 和
和![]() 的中子数相同
的中子数相同
C.Ti元素的相对原子质量为49D.![]() 和
和![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的有机中间体,可以由苯合成,具体合成路线如下:
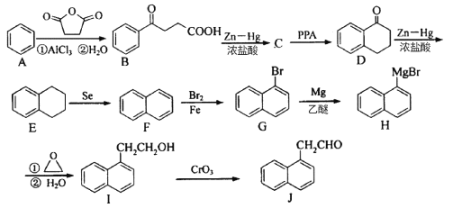
(1)J的化学式为__________________ ;F的名称为__________________。
(2)B中官能团名称为____________________ 。
(3)I—J的反应类型为____________________ 。
(4)F -G的反应方程式为____________________ 。
(5)与I属于同种类型物质且苯环上有两个取代基的同分异构体有____种。符合下列条件的J的一种同分异构体结构简式为______。
①属于芳香族化合物 ②不能与金属钠反应 ③有3种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定容器中,发生反应2HI(g)![]() H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
H2(g)+I2(g), 下列方法中能证明已达到平衡状态的是( )
①混合气体的颜色不再变化 ②![]() 各组分浓度相等 ③
各组分浓度相等 ③![]()
④一个H-H键断裂的同时有两个H-I键断裂 ⑤混合气体的平均摩尔质量不再变化
A. ①④ B. ①②④ C. ①③⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池充放电的总反应为:![]() ,下列关于铅蓄电池的说法正确的是( )
,下列关于铅蓄电池的说法正确的是( )
A. 在放电时,两极质量均增加
B. 在充电时,电池中硫酸的浓度不断变小
C. 在放电时,负极发生的反应是 Pb + 2e- + SO42-=PbSO4
D. 在放电时,正极发生的反应是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。
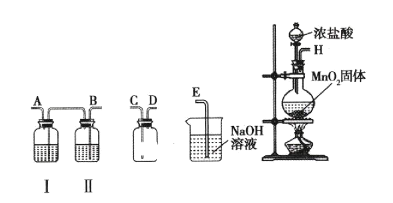
(1)I中所盛试剂为________(填序号,下同),II中所盛试剂为________。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→____、____、→____、____→____;选择最后一个装置的目的是___________________。
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:____。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有![]() ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。
I.提出合理假设。
假设1:该漂白粉未变质,含有_______________________;
假设2:该漂白粉全部变质,含有_________________________;
假设3:该漂白粉部分变质,既含有![]() ,又含有
,又含有![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
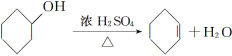
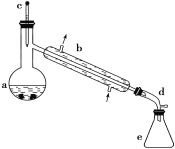
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com