
| O | 2-3 |
| O | 2-6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
| Kw[Fe(OH)3] |
| C3(OH-) |
| 2.6×10-39 |
| (1×10-10)3 |
| 0.002mol×171g/mol |
| 0.36g |


科目:高中化学 来源:不详 题型:实验题
 、
、 ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: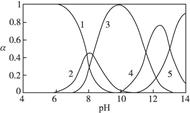
 ,5表示
,5表示
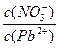 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 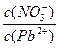 增大,可能的原因是_____________。
增大,可能的原因是_____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.①②③ | C.③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.
| B.
| C.14+
| D.14+
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S═CuS↓+2H+ |
| C.Zn2++S2-+2H2O═Zn(OH)2↓+H2S↑ |
| D.FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| K甲/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A.向该混合溶液中加入少量铁粉,立即能观察到有红色固体析出 |
| B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| C.该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 |
| D.向该混合溶液中加入适量氯水,并调节溶液的pH为3-4,然后过滤,可得到纯净的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.溶液中Ca2+数减少 | B.[Ca2+]增大 |
| C.溶液pH不变 | D.溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 | ||||||||
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 | ||||||||
C.BaSO4和BaCO3共存的悬浊液中
| ||||||||
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0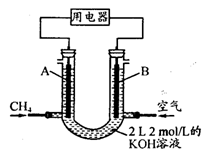
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com