
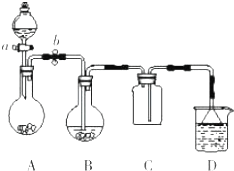
 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略). 分析 (1)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;有一定量的硫酸剩余但未能使铜片完全溶解是因为浓硫酸变稀后铜和稀硫酸不反应;
②装置B铜和浓硫酸反应,装置C收集二氧化硫,装置D进行尾气处理,装置C收集二氧化硫为向上排空法,应长进短出;
③装置A淡黄色固体为过氧化钠,和水反应制取氧气,铜、氧气和稀硫酸反应生成硫酸铜和水;
(2)①测定SO2的量必须做到不能在测量时损耗,便于测定分析,A考虑水蒸气的干扰,B考虑酸化高锰酸钾溶液中的硫酸根离子干扰,C考虑二氧化硫在水中的溶解性,D可行;
②铜离子溶液呈蓝色,对观察指示终点颜色有干扰.
解答 解:(1)①试管Ⅰ中发生的反应是铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,Cu只能与浓硫酸在加热条件下反应,而与稀硫酸不反应,随着反应的进行,硫酸的浓度逐渐下降,最后剩余,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;随着反应的进行,浓硫酸逐渐变稀,水逐渐增多,稀硫酸和铜不反应,反应停止;
②装置C收集二氧化硫,装置D进行尾气处理,装置C收集二氧化硫为向上排空法,应长进短出,
故答案为:装置C中导管应该长进短出;
③分液漏斗中的无色无味液体为水,滴入到装置A中淡黄色固体过氧化钠的表面,产生的无色气体为氧气,装置B中剩余Cu片继续溶解的原因为:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)①测定SO2的量必须准确测定无气体损耗,实验操作简单易行;
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故A不可行;
B、将装置A产生的气体缓缓通入足量的酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.过程中沉淀的质量是由二氧化硫被氧化生成的硫酸根离子和酸化高锰酸钾溶液中的硫酸根离子,所以测定不出二氧化硫的含量,故B不可行;
C、二氧化硫气体是易溶于水的物质,用排水法测定装置A产生气体的体积不准确,故C不可行;
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中 的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故D可行;
故答案为:ABC;
②甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰,
故答案为:否;虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰;
点评 本题考查了浓硫酸的性质应用,反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫的性质应用和含量测定,题目难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:实验题
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,8 | B. | 2,4,6 | C. | 1,3,6 | D. | 1,3,8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

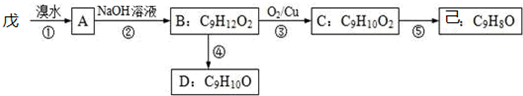
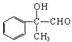
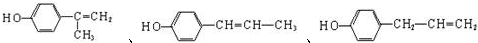 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
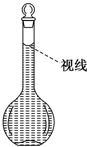 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶查看答案和解析>>
科目:高中化学 来源: 题型:解答题
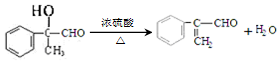
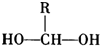 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 请根据图作答:
请根据图作答: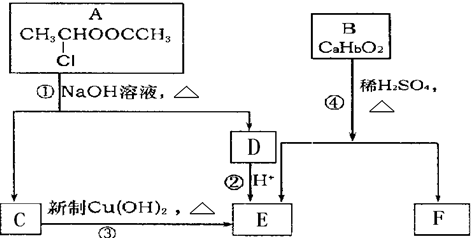

 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
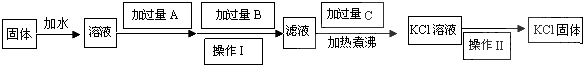
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com