
| A. | 用稀硝酸处理铁片 | B. | 用稀盐酸处理铁片 | ||
| C. | 用浓硝酸处理铁片 | D. | 用浓盐酸处理铁片 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 油滴的体积 | B. | 油滴的质量 | C. | 1 mol油酸的体积 | D. | 油酸的摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
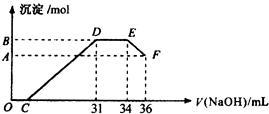 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期中同主族元素的最外层电子数及化学性质完全相同 | |
| D. | 同周期元素的原子半径从左到右依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com