
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
分析 1mol甲烷和一定物质的量的氯气混合均匀,以漫射光照射使之发生取代反应,生成的四种有机氯代物的物质的量相等,由碳守恒得每种氯代物的物质的量均为0.25 mol,每取代一个氢原子需要一个氯气分子,据此计算出所需氯气的物质的量.
解答 解:因为生成的四种有机氯代物的物质的量相等,由碳守恒得每种氯代物的物质的量均为0.25 mol,每取代一个氢原子需要一个氯气分子,所以所需氯气的物质的量为:0.25 mol×(1+2+3+4)=2.5 mol,
故选C.
点评 本题考查了化学方程式的计算、混合物反应的计算,题目难度中等,明确甲烷与氯气的反应原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、A13+、H+、Cl- | ||
| C. | NO3-、NH4+、K+、Cl- | D. | NO3-、K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若误饮c(Ba2+)=1.0×10-5mol/L溶液时,不会引起Ba2+中毒 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaCO3不能作内服造影剂 | |
| C. | 向同浓度Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 | |
| D. | 在BaSO4和BaCO3共存的悬浊液中,c(SO42-):c(CO32-)=1:51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6kJ•mol-1 | B. | -92.3kJ•mol-1 | C. | -69.2kJ•mol-1 | D. | +92.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定 | B. | 中和滴定 | ||
| C. | 过滤 | D. | 物质的量浓度溶液配制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中有下列平衡Cl2+H2O═HCl+HClO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 氨水中加入NaOH固体有利于氨气的溢出 | |
| D. | pH=1的盐酸加水稀释到原体积的100倍后,PH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.5% | B. | 9.1% | C. | 8% | D. | 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
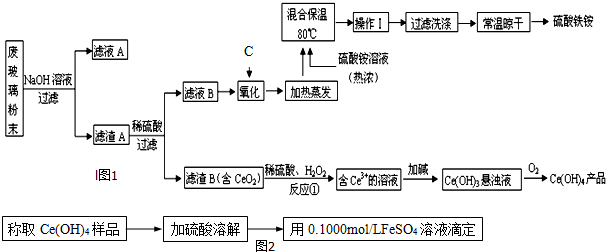
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com