
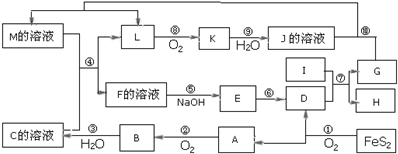
分析 FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,D为Fe2O3,C为B的水化物,则C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3,据此解答.
解答 解:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,D为Fe2O3,C为B的水化物,则C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3.
(1)G为Fe,是26号元素,位于周期表中第四周期第Ⅷ族,
故答案为:Fe;第四周期第Ⅷ族;
(2)反应⑦的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+Fe,Fe2O3是氧化剂、Al是还原剂,氧化剂与还原剂的物质的量之比为1:2,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+Fe;1:2;
(3)在反应②、③、⑥、⑨中,②、⑨都为氧化还原反应,⑥为分解反应,③为SO3+H2O=H2SO4,既属于化合反应又属于非氧化还原反应,故答案为:③;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
点评 本题考查无机物的推断,注意根据FeS2与氧气反应、物质的颜色等为突破口,根据框图寻找线索进行推断,需要学生熟练掌握元素化合物性质,题目难度中等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| B. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{2}{3}$ | |
| C. | 酒精着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol; |
| ② | 2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol; |
| ③ | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/moL; |
| ④ | C(s)+O2(g)═CO2(g)△H=-393.5kJ/moL; |
| ⑤ | CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ/moL |
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
| A. | H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol | |
| B. | 热化学方程式:C(s)+H2O(g)?H2(g)+CO(g)△H=+175.5kJ/moL | |
| C. | CH4的燃烧热△H=-802kJ/moL | |
| D. | 估算出C=O键能为800kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molB+1molD | ||
| C. | 2molA+1molB+3molC | D. | 1molA+0.5molB+1.5molC+0.6molD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A+2B?3C+D | B. | 3A+2B?2C+D | C. | 2A+B?3C+D | D. | 3A+B?2C+2D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氯气所含的原子数目为NA | |
| B. | 标准状况下,1.12LO2和1.12 L CO2均含有0.1NA氧原子 | |
| C. | 标准状况下,22.4L空气含有NA个单质分子 | |
| D. | 标准状况下,22.4LH2O含有NA个水分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com