
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:分析 (1)已知:I. 2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0,化学平衡常数为k1,
II.2NO(g)+Cl2(g)?2ClNO(g)△H2<0化学平衡常数为k2,
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),据此计算焓变,该反应平衡常数为①的平衡常数平方与②的商;
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,反应进行温度升高;
(3)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,结合化学三行计算列式,依据平衡混合物中 ClNO 的体积分数为y,计算得到;
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,据此分析判断;
解答 解:(1)已知:I. 2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0,化学平衡常数为k1,
II.2NO(g)+Cl2(g)?2ClNO(g)△H2<0化学平衡常数为k2
根据盖斯定律Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),△H=2△H1-△H2,该反应平衡常数K=$\frac{{{k}_{1}}^{2}}{{k}_{2}}$,
故答案为:2△H1-△H2;K=$\frac{{{k}_{1}}^{2}}{{k}_{2}}$;
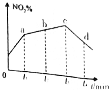
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,实验测得NO2( g )的转化率随时间变化的示意图中t3~t 4 时刻,NO2(g)的转化率 (NO2%)降低,因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低,
故答案为:因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低;
(3)2NO(g)+Cl2(g)?2ClNO(g) K2△H2<0,反应为气体体积减小的放热反应,
A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;
B.n ( ClNO )=n ( NO )不能说明正逆反应速率相同,不能证明反应达到平衡状态,故B错误;
C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ 正 ( ClNO ),υ 正 ( NO )=υ 逆 ( ClNO )说明ClNO的正逆反应速率相同,故D正确;
故答案为:AD;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,结合化学三行计算列式,
2NO(g)+Cl2(g)?2ClNO(g)
起始量(mol) x 1 0
变化量(mol) 2a a 2a
平衡量(mol) x-2a 1-a 2a
依据平衡混合物中 ClNO 的体积分数为:y=$\frac{2a}{x+1-a}$,
故答案为:$\frac{2a}{x+1-a}$;
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-);
溶液B为0.1mol•L-1的CH3COONa溶液,常温下,向溶液 B 中加水稀释过程中,
a.稀释过程中氢氧根离子浓度减小,溶液中存在离子积常数,则氢离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$比值增大,故a正确;
b.加水稀释促进电离,$\frac{c(O{H}^{-})}{c(C{H}_{3}COOH)}$比值增大,故b正确;
c.溶液中加水稀释,$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{n(N{a}^{+})}{n(C{H}_{3}CO{O}^{-})}$,醋酸根离子物质的量减小,比值增大,故c正确;
d.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$为电离平衡常数表达式,温度不变电离平衡常数不变,故d错误,
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-); abc.
点评 本题考查较为综合,涉及化学平衡常数的计算、影响化学平衡的因素分析应用、电解质溶液中盐类水解、离子浓度大小比较等知识,题目难度中等,明确化学平衡及其影响为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
化学与社会、环境等密切相关。下列说法错误的是( )
A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2的排放
C.所有垃圾都可以采用露天焚烧或深埋的方法处理
D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
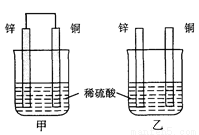
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在配制Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A.NaOH B.H2SO4 C.KCl D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) (△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)(△H=+57.3 kJ/mol (中和热) | |
| C. | S(s)+O2(g)=SO2(g) (△H=-269.8 kJ/mol (反应热) | |
| D. | 2NO2=O2+2NO (△H=+116.2 kJ/mol (反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com