
| 品名:XX火腿肠 净含量:150g 生产日期:见封口 保质期:25℃以下6个月 配料:精选瘦肉、大豆蛋白、鸡蛋、淀粉、白砂糖、食盐、 食用香精、山梨酸钾、亚硝酸钠、维生素C 储存指南:避免日晒,置阴凉干燥处 生产厂家:XX食品有限公司 地址:XX市XX路XX号 |
分析 (1)调味剂包括食盐、醋、味精、蔗糖、柠檬酸、甜蜜素、香精等,防腐剂包括食盐、醋、苯甲酸钠、山梨酸钾、亚硝酸盐等;
(2)火腿肠主要是由精肉加工而成的,富含大量的蛋白质;食物的酸碱性并非指味觉上的酸碱性,也不是指化学上所指的溶液的酸碱性,而是指食物在体内代谢最终产物的性质来分类;
(3)A.食品添加剂应依法合理使用;
B.很多食品添加剂是合成的;
C.柠檬黄具有黄色,可做着色剂
D.根据醋的性质分析.
(4)根据糖类、油脂、蛋白质的性质解答;
(5)维生素可分为分为脂溶性维生素和水溶性维生素两类,脂溶性维生素包括维生素A、维生素D、维生素E、维生素K等,水溶性维生素溶于水而不溶于脂肪,在体内不能储存,有B族维生素和维生素C.
解答 解:(1)表中的配料中属于调味剂的是白砂糖、食盐、食用香精;属于防腐剂的是食盐、山梨酸钾、亚硝酸钠;
故答案为:白砂糖;食盐或食用香精;食盐;山梨酸钾或亚硝酸钠;
(2)火腿肠主要是由精肉加工而成的,富含大量的蛋白质;蛋白质在人体内代谢最终产物为氨基酸,显酸性,属于酸性食物;
故答案为:蛋白质;酸性;
(3)A.食品添加剂应依法合理使用,在合理限量范围内使用不影响人体健康,故A正确;
B.很多食品添加剂是合成的,所以食品添加剂不一定用天然物质制造,故B错误;
C.柠檬黄具有黄色,可做着色剂,改善食品色泽,故C正确;
D.醋能作食品防腐剂,具有酸味可以用作调味剂,故D正确;
故选B;
(4)糖类、油脂、蛋白质能在人体中发生氧化,相同质量的糖类、油脂、蛋白质释放热量最高的是油脂;
故答案为:氧化;油脂;
(5)①维生素B ②维生素C属于水溶性维生素;③维生素D属于脂溶性维生素;
故答案为:③.
点评 本题主要考查食品添加剂的性质与用途,题目难度不大,掌握物质的性质是解题的关键,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硫酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 酸化的硫酸亚铁溶液中加入双氧水:Fe2++2H2O2═2Fe3++2H2O | |
| D. | 在氢氧化镁浑浊液中滴加氯化铁溶液:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
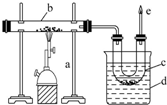 图是实验室干馏煤的装置图,回答下列问题:
图是实验室干馏煤的装置图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
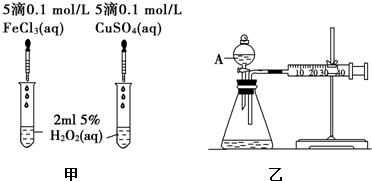
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
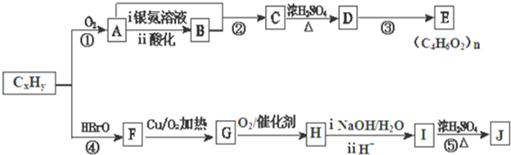
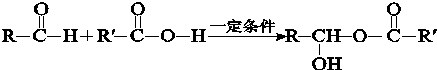

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com