
分析 反应平衡时溶液呈中性,c(H+)=c(OH-),平衡时溶液中c(NH4+)=2c(SO42-)=$\frac{4a}{b}$mol/L,根据物料守恒得n(NH3.H2O)=(a+bc-4a)mol=(bc-3a)mol,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,由此分析解答.
解答 解:反应平衡时溶液呈中性,c(H+)=c(OH-),平衡时溶液中c(NH4+)=2c(SO42-)=$\frac{4a}{b}$mol/L,根据物料守恒得n(NH3.H2O)=(a+bc-4a)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×\frac{4a}{b}}{\frac{bc-3a}{b}}$=$\frac{4a×1{0}^{-7}}{bc-3a}$,故答案为:$\frac{4a×1{0}^{-7}}{bc-3a}$.
点评 本题考查弱电解质电离平衡常数计算,注意电荷守恒的在解题中的应用,为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
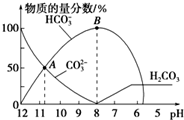 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
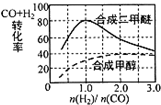 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
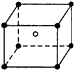
| A. | 1:8 | B. | 1:4 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com