
| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
分析 设14%的Ba(OH)2溶液的质量为m,根据溶质质量不变列方程计算溶液的质量,进而计算溶质的物质的量,根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:设14%的Ba(OH)2溶液的质量为m,则:
m×14%=(m-50g)×21%,
解得:m=150g,
m[Ba(OH)2]=150g×14%=21g,
n[Ba(OH)2]=$\frac{21g}{171g/mol}$=$\frac{21}{171}$mol,
c[Ba(OH)2]=$\frac{\frac{21}{171}mol}{0.08L}$=1.54mol•L-1,
故选C.
点评 本题考查溶液浓度的计算,涉及质量分数、物质的量浓度,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
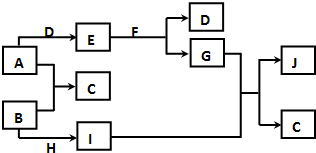 现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:
现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A、H为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(l)△H<0 | B. | 2FeCl3(aq)+Fe(s)═3FeCl2(aq)△H<0 | ||
| C. | CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(l)△H<0 | D. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若锌粉有剩余,则不溶物中一定有铜,可能有铁 | |
| B. | 若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ | |
| C. | 若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ | |
| D. | 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
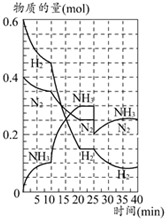 500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl NaClO HCl | B. | KCl KClO HClO | ||
| C. | Na2S Na2SO3 H2SO3 | D. | K2S K2SO3 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
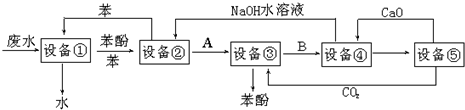
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com