
【题目】下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是。(填序号)
a.制汽轮机b.制有色玻璃
c.制永久性模具d.制造柴油机
(2)写出N的原子结构示意图 , 根据元素周期律知识,请写出氮化硅的化学式。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如你是一位企业家,在开发海水资源的众多项目中,选择了海水提镁,在前期考察过程中你将遇到许多问题,请根据背景材料的提示,按要求回答相关问题:
材料1:下图为海水中各元素含量情况(mg/L)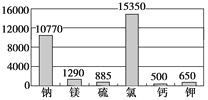
材料2:部分化学试剂的市场价格
试剂 | 氢氧化钾 | 氢氧化钠 | 氢氧化钙 | 氧化钙 |
价格(元/吨) | 5238.0 | 2300.00 | 1200.00 | 700.00 |
请回答下列问题:
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案:
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水后再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案最合理。
不选方案的理由是。
不选方案的理由是。
(2)应该选择试剂作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格比为。
(3)为了节省成本,你可考虑以海边上的贝壳为原料,试简述其理由:?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是绿色氧化剂,且酸性介质下由更强的氧化性,易溶于水显弱酸性,常温下K1=1×10﹣12 , K2=1×10﹣25 , 回答下列问题:
(1)常温下水的电离平衡的常数K约为 , K、K1、K2从大到小顺序为;
(2)在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH),反应后的混合物经过、蒸馏得到苯酚,理论上制取1mol苯酚需要消耗H2O2mol,实际消耗大于理论用量的主要原因是
(3)K4[Fe(CN)6](黄色溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现黄色、黄绿色交替变化,按照从酸性至碱性的顺序,可观察到的现象是;
(4)工业用H2O2除去废水中的Cl2 , 氧化产物是;与SO2除Cl2相比,其优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N.燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1:1:1:3.
(1)通过计算确定N的分子式
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( ) 
A.a点由水电离出的c(H+)=1.0×10﹣14mol/L
B.b点:c(NH4+)+c(NH3H2O)>c(Cl﹣)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中CH3COOH的质量).某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准.(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图,从下表中选出正确选项( )
锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 石蕊 | (乙) |
![]()
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如图1 
(1)合成塔中反应的化学方程式为;△H<0.从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 .
(2)从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母)
A.过滤
B.分液
C.蒸馏
D.结晶
(3)在体积为2L的合成塔中,充人2mol CO2和6mol H2 , 测得CO2(g)和CH3OH(g)的浓度随时间变化如图2所示. 从反应开始到平衡,V(H2)=;能使平衡体系中 ![]() 增大的措施有 .
增大的措施有 .
(4)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4 . 巳知
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣890.3kJ/mol
H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.5kJ/mol
O2(g)═H2O(l)△H2=﹣285.5kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com