
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,质量为_______g。
(2)质量相同的①HCl ②NH3 ③CO2 ④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
(4)0.2 mol NH3分子中所含氢原子数与________个H2O分子中所含氢原子数相等。
(5)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_______。
【答案】1.5NA 32 ③ 95g/mol 0.3NA 106 g/mol
【解析】
(1)根据N=nNA、m=nM计算出0.5mol二氧化硫中含有的分子数、质量;
(2)根据n=![]() 可知,质量相同时,摩尔质量越大,物质的量越小,则同温同压下体积与物质的量成正比;
可知,质量相同时,摩尔质量越大,物质的量越小,则同温同压下体积与物质的量成正比;
(3)根据该金属氯化物的化学式及氯离子的物质的量可以计算出该金属氯化物的物质的量,然后根据M=![]() 计算出ACl2的摩尔质量;
计算出ACl2的摩尔质量;
(4)结合分子含有H原子数目计算水的物质的量,再根据N=nNA计算水分子数目;
(5)结合质量守恒及M=![]() 计算;
计算;
(1)二氧化硫是三原子分子,故0.5molSO2中含1.5mol原子即1.5NA个;0.5mol二氧化硫的质量m=64g/mol×0.5mol=32g;故答案为:1.5NA;32;
(2)同温同压下,气体的体积与气体的物质的量成正比,根据V=![]() ×Vm,而当质量相同时,物质的量和摩尔质量成反比,故质量相同时,体积和摩尔质量成反比,则所占的体积最小的即摩尔质量最大的,四种气体中摩尔质量最大的二氧化碳,故答案为:③;
×Vm,而当质量相同时,物质的量和摩尔质量成反比,故质量相同时,体积和摩尔质量成反比,则所占的体积最小的即摩尔质量最大的,四种气体中摩尔质量最大的二氧化碳,故答案为:③;
(3)19g某二价金属的氯化物ACl2中含有0.4molCl-,则ACl2的物质的量为:n(ACl2)=0.4mol×![]() =0.2mol,ACl2的摩尔质量为:M(ACl2)=
=0.2mol,ACl2的摩尔质量为:M(ACl2)=![]() =95g/mol,故答案为:95g/mol;
=95g/mol,故答案为:95g/mol;
(4)0.2 molNH3分子中所含氢原子为0.2 mol×3=0.6 mol,与0.2 mol氨气含有相等氢原子数目的H2O的物质的量为![]() =0.3 mol,故水分子数目=0.45mol×NAmol-1=0.3 NA,故答案为:0.3 NA;
=0.3 mol,故水分子数目=0.45mol×NAmol-1=0.3 NA,故答案为:0.3 NA;
(5)16gA和20gB恰好完全反应生成0.04molC和31.76gD,根据质量守恒,0.04molC的质量为:16g+20g-31.76g=4.24g,则C的摩尔质量为![]() =106g/mol,故答案为:106g/mol。
=106g/mol,故答案为:106g/mol。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有![]()
C.向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状。
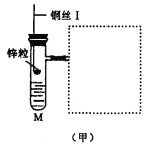
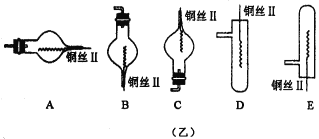
(1)在图甲中,试管M中的液体应选用_________________。
(2)在图示的虚线框中应连入的最合适的装置是___________(填代号)。
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有(写两点):__________________;________________ 。
(4)实验时,细铜丝“Ⅱ”的操作方法是_____________________________________________
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体应该是______________________,可用______________代替锌粒(写化学式), 发生反应的离子方程式为: _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是

A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醛和苯酚为主要原料,经下列转化可合成酚醛树脂和主要的有机合成中间体D(部分反应条件和产物已略去)
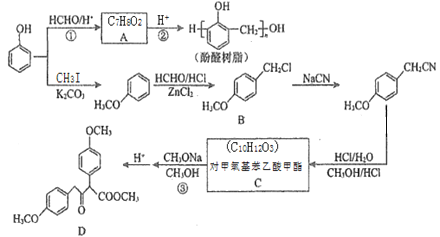
已知:R1CH2COOCH3+R2COOCH3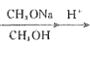 CH3OH+
CH3OH+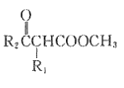
请回答下列问题:
(1)C中所含官能团名称为___________;D的化学式为_______。
(2)反应②的化学方程式为_________________。
(3)芳香族化合物E(C8H10O2)与B的水解产物互为同分异构体,1mol E可与2mol NaOH反应,其核磁共振氢谱中有3组峰,且峰面积比为3:1:1,则E有______种可能的结构(不考虑立体异构)。
(4)以CH3OH和CH3ONa为原料(其它试剂任选),设计制备CH3COCH2COOCH3的合成路线:CH3OH![]() ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,下列溶液与1.0×10-5mol/L的NaOH溶液的pH相同的是( )
A. 把pH=6的盐酸稀释1 000倍
B. 把pH=10的Ba(OH)2溶液稀释10倍
C. 把pH=8和pH=10的NaOH溶液等体积混合
D. 把pH=8的NaOH溶液稀释10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中颜色变化,直到加入一滴盐酸,溶液的颜色由____色变为_____,且半分钟不褪色,即停止滴定。
(2)下列操作中使所测氢氧化钠溶液的浓度数值偏高的是________(填序号)。
A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C、酸式滴定管在滴定前有气泡,滴定后气泡消失
D、读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
E、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
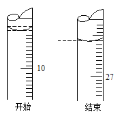
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示:则起始读数为_____mL,终点读数为_____mL。
(4)如已知用c(HCl) = 0.1000 mol/L的盐酸滴定20.00 mL的氢氧化钠溶液,测得的实验数据如(3)中记录所示,则该氢氧化钠溶液的浓度c(NaOH) =____mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
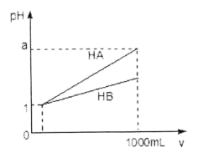
A. 同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B. 物质的量浓度HA<HB
C. 若1<a<4,则HA、HB都是弱酸
D. 体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com