
| A. | 升高温度 | B. | 增大压强 | C. | 增大NH3的浓度 | D. | 使用催化剂 |
科目:高中化学 来源: 题型:选择题
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
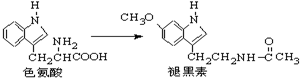
| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 | |
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 | |
| C. | 在一定条件下,色氨酸可发生缩聚反应 | |
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
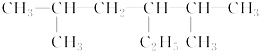 的名称是2,5-二甲基-3-乙基己烷
的名称是2,5-二甲基-3-乙基己烷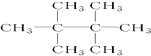 名称是2,2,3,3-四甲基丁烷.
名称是2,2,3,3-四甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显酸性 | B. | NaH中氢离子电子层排布与氦相同 | ||
| C. | NaH中氢离子半径比锂离子半径小 | D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

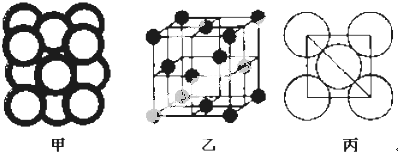
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com