
| A. | Q1=Q | B. | 平衡时甲中C的体积分数比乙中小 | ||
| C. | 达到平衡时,甲中A的转化率为90% | D. | Q1+Q2>Q |
分析 由于1mol A和2mol B完全反应可以生成2molC,所以甲乙两个体系的平衡状态是一样的,即对应气体的浓度完全相同. 对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反,1mol A和2mol B完全反应时放热Q,则2molC完全分解时吸热也是Q,
根据三段式利用x表示出平衡时甲容器内反应混合物各组分的物质的量为 A(1-x )mol、B(2-2x )mol、C2xmol,放出热量Q1=xQkJ;
则乙容器反应混合物各组分的物质的量也是为A(1-x )mol、B(2-2x )mol、C2xmol,所以分解的C的物质的量为(2-2x)mol,吸收热量(1-x)QkJ,利用Q1=9Q2,列放出求出x的值,据此分析解答.
解答 解:A、由于1mol A和2mol B完全反应可以生成2molC,所以甲乙两个体系的平衡状态是一样的,即对应气体的浓度完全相同. 对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反,1mol A和2mol B完全反应时放热Q,则2molC完全分解时吸热也是Q,
假设甲容器中的参加反应的A的物质的量为xmol,所以:
对于甲容器:A(g)+2B(g)═2C(g)△H=-Q kJ/mol
起始(mol):1 2 0
变化(mol):x 2x 2x
平衡(mol):1-x 2-2x 2x
所以Q1=xQkJ,
乙容器反应混合物各组分的物质的量也是为A(1-x )mol、B(2-2x )mol、C2xmol,所以分解的C的物质的量为(2-2x)mol,
对于乙容器:A(g)+2B(g)═2C(g)△H=-Q kJ/mol,故吸收的热量Q2=$\frac{2-2x}{2}$×QkJ=(1-x)QkJ,
所以Q1=0.9Q,故A错误;
B、甲乙容器中达到的平衡是相同平衡,所以平衡时甲中C的体积分数与乙相等,故B错误;
C、根据A的解答,甲中A的转化率为$\frac{0.9}{1}$=90%,故C正确;
D、根据A的解答,Q1+Q2=Q,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度较大,注意等效平衡的应用,解答该题时利用三段式法较为直观,试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2HCl=2NaCl+CO2↑+H2O | B. | K2CO3+2HNO3=2KNO3+CO2↑+H2O | ||
| C. | K2CO3+H2SO4=K2SO4+CO2↑+H2O | D. | CaCO3+2HCl=CaCl2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
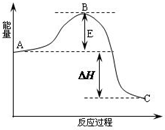 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL | B. | 20mL | C. | 50mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com