
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
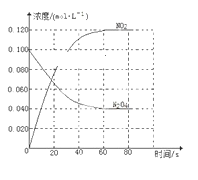
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如下图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T________(填“大于”或“小于”)100 ℃,判断理由是________________________________。
b.温度T时反应的平衡常数K2=____________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________。
【答案】大于 0.001 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 1.28 逆反应 将反应容器的体积减小一半,即增大压强,当其他条件不变时,增大压强,平衡向气体物质化学计量数减小的方向移动,即向逆反应方向移动
【解析】
本题考查影响化学平衡移动的因素和平衡常数的计算。根据升高温度化学平衡向吸热方向移动,增大压强平衡向气体体积数减小的方向移动。以此进行判断!
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即ΔH大于0,在0~60 s时段,N2O4浓度变化为0.1 mol·L-1-0.04 mol·L-1 = 0.06 mol·L-1,反应速率v(N2O4)为0.06 mol·L-1/60s=0.001mol·L-1,答案:0.001。
(2) a.因为正反应方向吸热,100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,说明平衡向正反应方向移动,所以T大于100℃。答案:大于 (4). 反应正方向吸热,反应向吸热方向进行,故温度升高。
b.温度T时反应达平衡后c(N2O4)=0.12 mol·L-1+0.002 mol·L-1·s-1![]() 10s
10s![]() 2=0.16 mol·L-1
2=0.16 mol·L-1
平衡时c(N2O4)=0.04 mol·L-1+0.002 mol·L-1·s-1![]() 10s
10s![]() 2=0.02 mol·L-1,反应的平衡常数K2= c2(NO2)/ c(N2O4)= (0.16)2/0.02=1.28
2=0.02 mol·L-1,反应的平衡常数K2= c2(NO2)/ c(N2O4)= (0.16)2/0.02=1.28
(3)温度T时反应达平衡后,将反应容器的容积减少一半,即增大压强向着气体体积减小的方向移动,即平衡向逆反应。答案:逆反应 、将反应容器的体积减小一半,即增大压强,当其他条件不变时,增大压强,平衡向气体物质化学计量数减小的方向移动,即向逆反应方向移动。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示土壤中甲、乙两种元素浓度变化与某植物生长速率的关系,下列分析正确的是( )

A.该植物生长对甲元素的需求大于乙元素
B.当土壤中乙元素浓度为B时,施含乙元素的肥料最有利于该植物生长
C.当该植物生长速率最大时,对甲、乙元素的需求量相近
D.持续保持甲、乙元素供应量相等可能会导致该植物生长不正常
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B. 标准状况下,11.2L苯中含有分子的数目为0.5NA
C. 2L0.5mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
D. 标准状况下,22.4L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
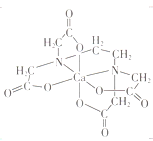
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
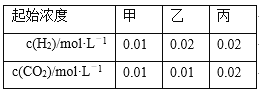
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别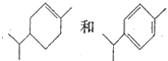
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用有机原料A制备 和聚乙酸乙烯酯,其流程为:
和聚乙酸乙烯酯,其流程为:

已知:①![]() ②
②![]()
请回答下列问题:
(1)A→B的反应类型是___________,J中官能团的名称为___________。
(2)反应②的试剂和条件分别是___________,G的结构简式是___________。
(3)写出反应①的化学方程式:_________________________________。
(4)与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,写出其中一种核磁共振氢谱为五组峰且能发生银镜反应的结构简式为______________________。
(5)参照下述示例合成路线,设计一条由乙二醇为起始原料制备聚乙二酸乙二醋的合成路线。示例:![]() _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某化工厂提供的硒酸泥(主要含S、Se、Fe2O3及SiO2)中提取粗硒的工艺流程如下图所示:

备注:氧化浸出液中Se的含量为43.45g/L
根据以上信息回答下列问题:
(1)把煤油加热后再进行浸泡的目的是:__________________________。
(2)将含硫的滤液进行“冷却、结晶、过滤”操作可以除去煤油中的硫,由这一操作可推测硫的物理性质是:__________________________。
(3)“氧化浸硒”过程中:
①需要控制H2SO4的浓度至少为3mol/L,理由是:__________________________。
②硒转化为H2SeO3并生成一种黄绿色的气体,此过程的化学方程式为_______________。
(4)要将1L氧化浸出液中的硒元素全部还原,需要至少加入Na2SO3_____mol;
(5)滤渣A的主要成分有___________;滤液B的金属阳离子有___________;
(6)处理硒酸泥的另一种方法是往硒酸泥中加入等体积的浓硫酸进行焙烧,本工艺流程与此方法相比主要的优点是(写两点):__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com