
 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为:____________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________。
科目:高中化学 来源: 题型:
工业常用浓硫酸分解钛铁矿FeTiO3(含有FeO、Fe2O3杂质)方法来制备钛白(TiO2)工艺流程如下图所示。
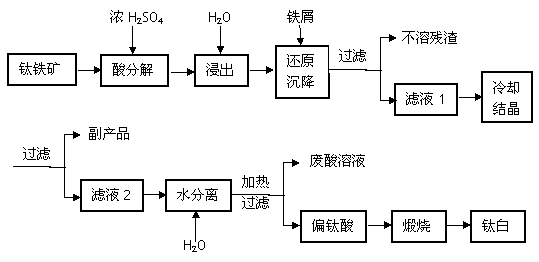
 金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。
金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。


回答下列问题:
(1)浓硫酸处理钛铁矿时生成两种硫酸盐且无气体放出,写出FeTiO3(Fe+2价)在浓硫酸中分解的反应方程式_____________________________________________________;
(2)加铁屑的目的是___________________________________(用离子方程式表示),滤液1冷却结晶得到副产品的俗称是______________________(写名称);
(3)滤液2稀释加热水解得到偏钛酸(H2TiO3)的方程式______________________________;
(4)冶炼金属钛时反应①通常在800~900℃的条件下进行,产物中还有一种可燃性无色气体,该反应的方程式为______________________________________________________。
(5) 冶炼金属钛时反应②也在800~900℃的条件下进行,反应中需要加入氩气的理由是___________________;反应后的产物中需要加入_____________才能达到分离的目的。
(6)已知25℃、100kPa时TiCl4为液态,实验测得该条件下12g镁反应能释放出266.1kJ 热量,反应②的热化学方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500ml容量瓶进行配置,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500ml水 B.称取12.0g胆矾配成500ml溶液
C.称取8g硫酸铜,加入500ml水 D.称取12.5g胆矾配成500ml溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是具有抗氧化和抗肿瘤作用成分.化合物Ⅴ也可通过图所示方法合成:


已知 、
、
(1)反应①的类型________
(2)化合物Ι的分子式________
(3) ①A的结构简式_______。
② 1molV最多消耗NaOH ____。1mol肉桂酸最多消耗H2 _______mol
(4)化合物I和Ⅱ反应还可以得到一种酯,该反应的化学方程式是
(5)关于Ⅴ的说法正确的是( )
A.分子中有三个苯环 B.能发生水解反应
C.使酸性KMnO4溶液褪色 D.与FeCl3发生显色反应
(6)写出肉桂酸的一种同分异构体的结构简式 ,满足一下两个条件:
①分子中含有苯环 ②羧基与苯环直接相连
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是
A.酸性KMnO4溶液与双氧水反应:2MnO + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+ 8H2O
+ 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+ 8H2O
B.NH4HSO3溶于过量NaOH溶液中: HSO +OH- = SO32—+H2O
+OH- = SO32—+H2O
C.向氯化银悬浊液中滴入饱和碘化钾溶液:Ag+ + I-= AgI ↓
D.标准状况下672mL Cl2通入100mL0.1 mol·L-1FeBr2溶液中:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
对右图装置说法正确的是( )
A.a电极上发生还原反应
B.盐桥中的阴离子向b电极移动
C.一段时间后,c电极区溶液的pH降低
D.—定时间内,向d电极区滴入黄色K3[Fe(CN)6]溶液,可能出现Fe3[Fe(CN)6]2蓝色沉淀

查看答案和解析>>
科目:高中化学 来源: 题型:
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
① 请结合上表数据,写出NO与活性炭反应的化学方程式 。
② 上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= ,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96 L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为 ,
所得溶液中离子浓度由大到小的顺序为 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。现将浓度为2×10—4mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为 。
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生
反应为 ,则b电极的电
,则b电极的电
极反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
芳香烃是指 ( )
A.分子里含有苯环的化合物 B.分子组成符合CnH2n-6 通式的一类有机物
C.分子里含有一个或多个苯环的烃 D.苯和苯的同系物的总称
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应。

先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少。
(1)请写出上述过程A装置中所涉及的化学反应方程式。
______________________________________________;
______________________________________。
(2)张老师认为装置设计有误,你认为_________(填“A”、 “B”或“C”)部分有误。
(3)B中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式:___ _____________________________________________。
(4)装置C的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com