
.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下试验:
(1)取样品 ag ,称取时使用的仪器名称为 。
(2)将样品溶于足量的稀盐酸中,过滤,滤渣中含有 ,在溶解过滤时使用的玻璃仪
器有 。
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式 。
(4)在第( 3 )步的滤液中通入足量CO2,过滤。有关反应的离子方程式是 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至质量不再减轻为止,冷却后称量,质量为bg,则原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏 (填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏 ;若滤渣燃烧不充分,则实验结果偏 。
(1)托盘天平 (2)硅、铜;烧杯、漏斗、玻璃棒
(3) Al3+ + 4OH- = [Al(OH)4] -、Mg2+ + 2OH- = Mg(OH)2↓
(4) [Al(OH)4] -+ CO2 = Al(OH)3↓+ HCO3- (5) 9b/17a (6) 低 ;高 ;高
【解析】(1)称量固体药品使用托盘天平。
(2)铜、硅和盐酸不反应,所以滤渣是铜和硅。溶解过滤时使用的玻璃仪器有烧杯、漏斗、玻璃棒。
(3)加入强酸生成氢氧化镁和氢氧化铝沉淀,但氢氧化铝是两性氢氧化物,能溶于强碱中。有关的方程式为Al3+ + 4OH- = [Al(OH)4] -、Mg2+ + 2OH- = Mg(OH)2↓。
(4)滤液中含有偏铝酸盐,通入CO2生成氢氧化铝沉淀,方程式为[Al(OH)4] -+ CO2 = Al(OH)3↓+ HCO3-。
(5)沉淀是氢氧化铝,灼烧得到氧化铝,所以铝放热质量分数为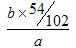 =9b/17a。
=9b/17a。
(6)若步骤(3)中加入氢氧化钠的量不足,则滤液中偏铝酸盐的量就偏低,最后结果偏低。若步骤(5)中滤渣没有洗涤,则实验结果偏,则氢氧化铝的质量偏大,结果偏高。若滤渣燃烧不充分,则氧化铝就偏高,结果偏高。


科目:高中化学 来源: 题型:
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2 。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480 mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与(5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市西南大学附属中学高一上学期期末考试化学试卷 题型:填空题
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480  mL, 应量取市售浓盐酸________mL进行配制。
mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012年山东济南外国语学校高一下学期期中考试化学试卷(带解析) 题型:实验题
.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下试验:
(1)取样品 ag ,称取时使用的仪器名称为 。
(2)将样品溶于足量的稀盐酸中,过滤,滤渣中含有 ,在溶解过滤时使用的玻璃仪
器有 。
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式 。
(4)在第( 3 )步的滤液中通入足量CO2,过滤。有关反应的离子方程式是 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至质量不再减轻为止,冷却后称量,质量为bg,则原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏 (填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏 ;若滤渣燃烧不充分,则实验结果偏 。
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高一上学期期末考试化学试卷 题型:填空题
(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2 。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480 mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com