
分析 钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N,将燃烧产物投入水中,得到一种纯净气体0.224L为氧气,根据氧气计算过氧化钠物质的量,溶液中Na元素以NaOH形式存在,25 mL溶液中n(NaOH)=1.25×10-2mol,消耗n(HCl)=1.35×10-2mol>n(NaOH),说明溶液中还有氨水,计算原l L溶液中n(NH3•H2O),再根据Na3N+4H2O═3NaOH+NH3•H2O计算Na3N的物质的量,根据Na原子守恒计算n(Na2O).
解答 解:n(Na)=$\frac{11.5g}{23g/mol}$=0.500 mol
钠在有限的空气中燃烧可能有Na2O、Na2O2、Na3N.
将燃烧产物投入水中,得到一种纯净气体0.224L为氧气,则n(O2)=$\frac{0.224L}{22.4L/mol}$=0.0100 mol
2Na2O2+2H2O═4NaOH+O2↑
0.0200 mol 0.0100 mol
溶液中Na元素以NaOH形式存在:Na→NaOH,则c(NaOH)=$\frac{0.5mol}{1L}$=0.500mo1•L-1,25 mL溶液中n(NaOH)=0.025L×0.500mo1•L-1=1.25×10-2mol,消耗n(HCl)=0.0135L×1.00mo1•L-1=1.35×10-2mol>n(NaOH),说明溶液中还有氨水.
原l L溶液中n(NH3•H2O)=$\frac{1000mL}{25mL}$×(1.35×10-2mol-1.25×10-2mol)=4.00×10-2mol,
Na3N+4H2O═3NaOH+NH3•H2O
4.00×10-2 mol 4.00×10-2mol
即n(Na3N)=0.0400mo1
n(Na2O2)=0.0200mol
n(Na2O)=(0.500 mo1-0.0400 mo1×3-0.020 mo1×2)÷2=0.170 mo1,
答:钠在空气中燃烧产物及物质的量为:n(Na3N)=0.0400mo1、n(Na2O2)=0.0200mol、n(Na2O)=0.170 mo1.
点评 本题考查化学方程式计算、混合物计算,注意利用守恒法计算解答,关键是根据HCl与NaOH物质的量关系判断产物中含有Na3N.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 反应Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,向甲试管中滴加5ml 0.05mol/L的Na2S2O3和5ml 0.02mol/LH2SO4,乙试管中滴加10ml 0.05mol/L的Na2S2O3和10ml 0.02mol/LH2SO4 | 探究浓度对化学平衡的影响 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| B. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L | |
| C. | 溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1的溶液的物质的量浓度为$\frac{ρw}{M}$ mol/L | |
| D. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
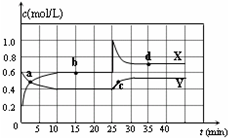 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A. | 图中Y曲线是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内v(N2O4)为0.1 mol/( L•min) | |
| C. | 25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | |
| D. | 25 min时,导致平衡移动的原因是向容器通入适量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 | |
| B. | c(H+)=1.0×10-7mol•L-1的溶液 | |
| C. | pH=7的溶液 | |
| D. | 室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com