

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
分析 (1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;
(2)Mn2+离子易水解;
(3)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据操作方法判断缺少的仪器;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(5)由于将一级沉降根据MnS的Ksp=c(Mn2+)•c(S2-)进行计算即可.
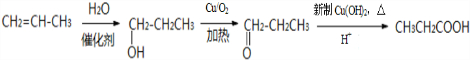
解答 解:向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰.
(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O,
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)Mn2+离子易水解.加入过量硫酸,还可以抑制Mn2+的水解,
故答案为:抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)步骤Ⅲ为过滤操作,需要用到的玻璃仪器除玻璃棒、漏斗外,还需要烧杯;
由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成,
故答案为:烧杯;CoS和NiS;
(5)MnS的Ksp=c(Mn2+)•c(S2-)=1.0×10-11,为了将Mn2+降到1.0×10-5mol/L,则c(S2-)=$\frac{{K}_{sp}}{c(M{n}^{2+})}$=$\frac{1.0×1{0}^{-11}}{1.0×1{0}^{-5}}$=1.0×10-6mol/L,即硫化钠的浓度是1.0×10-6mol/L,
故答案为:1.0×10-6.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确制备原理为解答关键,注意掌握难溶物溶解平衡及溶度积的有关计算方法,试题培养了学生的分析、理解能力及化学实验能力.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:多选题
| A. | 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 | |
| C. | 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水后,c(CH3COO-)会大于c(Na+)、c(NH4+)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
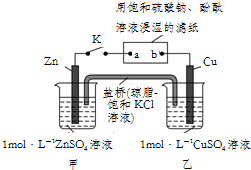
| A. | 盐桥中的Cl-向甲池移动,滤纸上的SO42-向b移动 | |
| B. | 电子流动沿Zn→a,b→Cu的路径 | |
| C. | Cu电极上的反应为:Cu2++2e-═Cu,滤纸a点发生还原反应 | |
| D. | 片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
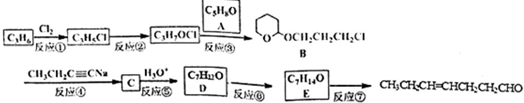
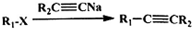
 、CH3CH2C≡CCH2CH2CH2OH;
、CH3CH2C≡CCH2CH2CH2OH;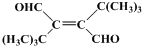 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )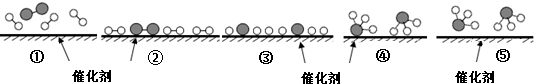
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉 | Na具有强还原性 |
| B | 明矾可用作净水 | 明矾能杀菌消毒 |
| C | SO2可用于漂白纸浆 | SO2具有强氧化性 |
| D | SiO2可用于制造光导纤维 | SiO2具有导电性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| B. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、S2- | |
| D. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com