


 ,
, ;
;

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 如图是探究氯气某性质的实验装置图:
如图是探究氯气某性质的实验装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
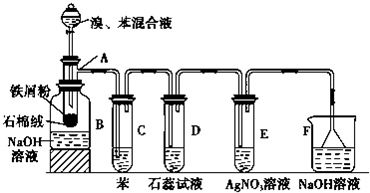
| FeBr3 |
| FeBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:


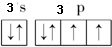

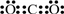
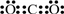


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白
脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com