
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
分析 MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,并根据原子守恒计算反应的溶液中氯离子的物质的量,以此解答该题.
解答 解:n(MnO2)=$\frac{6.96}{87}$=0.08mol,n(HCl)=$\frac{100×36.5%}{36.5}$=1mol.
A.V=nVm由于题目未注明状态,故无法计算气体氯气的体积,故A错误;
B.MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 1
0.08 0.08
n损(Cl-)=2n(Cl2)=0.08×2=0.16mol
n剩(Cl-)=1-0.16=0.84mol
则n稀(Cl-)=$\frac{25}{250}$×0.84=0.084mol,根据氯元素守恒得n(AgCl)=n稀(Cl-)=0.084mol,则m(AgCl)=0.084×143.5=12.054g,故B错误;
C.由方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O知当中4HCl只有2HCl价态从-1变化到0价,因此4HCl被还原的盐酸只有2HCl(2:1)
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 4
0.08 0.32
则被还原的HCl为$\frac{0.32}{2}$=0.16,故C正确;
D.MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O∽2e-
1 2
0.08 0.16
故D正确;
故选CD.
点评 本题考查根据方程式进行的有关计算,难度不大,注意利用原子守恒计算反应的溶液中氯离子的物质的量.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建筑要使用大量的沙,常使用内陆河的河沙及海洋的海沙 | |
| B. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不相同 | |
| D. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
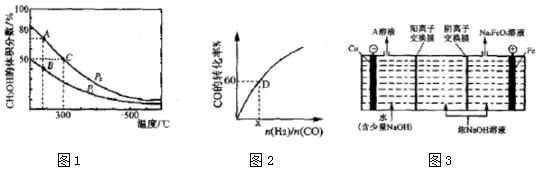
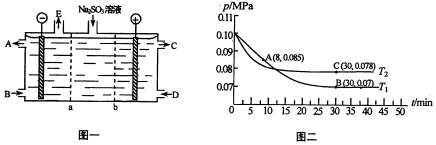
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
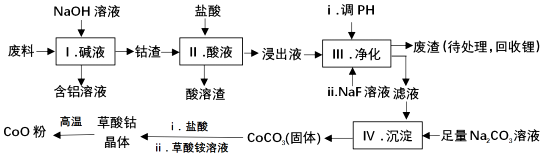
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向盛有1mLmol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀产生,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转变为红褐色 | |
| C. | 重铬酸钾酸性溶液中加入乙醇,溶液由墨绿色变为橙黄色 | |
| D. | 用石墨作电极电解CuCl2溶液可观察到阳极石墨棒上覆盖一层红色的铜,阴极石墨棒上生成能使湿润碘化钾淀粉试纸变蓝的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com