
分析 给出八种离子形成四种可溶性物质,可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定;如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,只能和NO3-结合,则一定是BaCl2、AgNO3;Fe2+不能和CO32-结合,所以只能为FeSO4;Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、FeSO4、Na2CO3;
(1)中其中呈现淡绿色的只有B盐溶液,所以B为FeSO4;
(2)四支试管加入盐酸,C盐溶液中有沉淀生成,A盐溶液中有无色无味的气体逸出,则C为AgNO3,A为Na2CO3,故D只能为BaCl2,据此进行解答.
解答 解:A、B、C、D四种可溶性盐,则Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,只能和NO3-结合,则一定是BaCl2、AgNO3;Fe2+不能和CO32-结合,所以只能为FeSO4;Na+只能与CO32-结合为Na2CO3,则四种物质为BaCl2、AgNO3、FeSO4、Na2CO3;
(1)将四种盐分别配成少量溶液,其中呈现淡绿色的只有B盐溶液,则B为FeSO4;
(2)向上述溶液中分别加入盐酸,C盐溶液中有沉淀生成,则C为AgNO3;A盐溶液中有无色无味的气体逸出,则A为Na2CO3,故D只能为BaCl2,
根据分析可知,A为Na2CO3,B为FeSO4,C为C为AgNO3,D为BaCl2,
故答案为:Na2CO3;FeSO4;AgNO3;BaCl2.
点评 本题考查无机物的推断,涉及常见离子的性质及检验,为高频考点,把握离子之间的反应、离子的颜色为解答的关键,注意B为硫酸亚铁为突破口,侧重分析、推断能力的综合考查.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
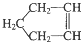 可简写为
可简写为 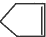 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: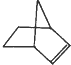
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S Mn(OH)2 MgCl2 H2O | |
| B. | HF KOH CO Na2CO3 | |
| C. | NH3 Al(OH)3 KBr MgO | |
| D. | H2O NaOH NH4Cl NH3﹒H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
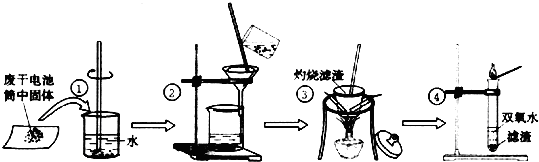
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 产生白色沉淀 | 含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ k |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
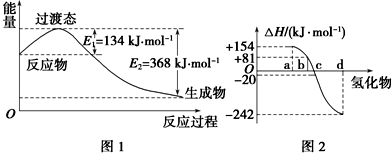
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
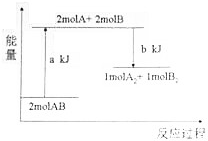
| A. | 该反应是放热反应 | |
| B. | 该反应一定要在加热条件下才能进行 | |
| C. | 断开lmolA2中的化学键和lmolB2中的化学键需吸收akJ的能量 | |
| D. | 1moIA2和1moIB2的总能量高于2molAB的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
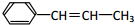 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能发生加聚反应,其生成物可用 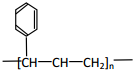 来表示 来表示 | |
| C. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| D. | 可以发生加成、取代、氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com