
| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
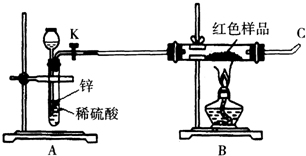
 在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )| 干燥气体a | 液体b | |
| A | NO2 | 水 |
| B | C12 | 饱和食盐水 |
| C | NH3 | 水 |
| D | CO2 | 4mol?L-1 NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3.2 | 6.0 | 6.5 | 7 |
| CO | C-O | C=O | C≡O | ||
键能(kJ?mol
| 357.7 | 798.9 | 1071.9 | ||
| N2 | N-N | N=N | N≡N | ||
键能(kJ?mol
| 154.8 | 418.4 | 941.7 |
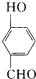 比
比 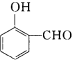 的沸点
的沸点查看答案和解析>>
科目:高中化学 来源: 题型:
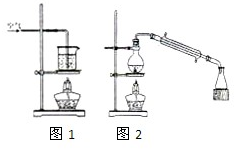 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.查看答案和解析>>
科目:高中化学 来源: 题型:
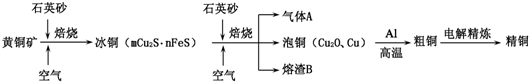
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的放热反应都能在常温常压下自发进行 |
| B、Ba(OH)2?8H2O与NH4Cl反应属于放热反应 |
| C、天然气燃烧时,其化学能全部转化为热能 |
| D、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com