
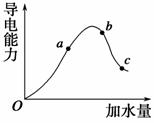
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
(1)O点为什么不导电______________________ _________________________________________。
(2)a、b、c三点的pH由小到大的顺序是 。
(3)H+的物质的量最大的是(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的(填序号)。
A.加热 B.加很稀的NaOH溶液
C.加NaOH固体 D.加水
E.加固体CH3COONa F.加入锌粒
解析 (1)冰醋酸中无自由移动的离子,所以在O点时不导电。(2)pH的大小与c(H+)有关,pH大则c(H+)小。导电能力与离子浓度有关,在醋酸溶液中离子主要来源于醋酸的电离,醋酸溶液的导电能力越强,说明c(H+)越大。(3)溶液稀释过程中,电离平衡向电离方向移动,氢离子的物质的量增大。(4)若使c(CH3COO-)增大,即促进CH3COOH的电离平衡向电离方向移动,A、B、C、D、F选项均可以达到使电离平衡向电离方向移动的目的。B、D项虽然能使CH3COOH的电离平衡向电离方向移动,但是稀释占据了主导作用,导致c(CH3COO-)减小。E项中虽然CH3COOH的电离受到抑制,但加入的CH3COO-能使c(CH3COO-)增大。
答案 (1)无自由移动的离子 (2)b<a<c (3)c (4)ACEF


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
图中所有字母均代表有机物,根据图中反应流程,回答下列问题:

已知:A是一种最简单的有机物,E是一种一氯代有机酸,其中氯原子的质量分数为28.98%,且该物质中原子个数比C∶O=2∶1,含2个甲基。
(1)请写出E的分子式__________,并写出G的结构简式:__________;
(2)图中所示的取代反应共有__________个;
(3)请写出下列转化的化学方程式:
C→D_____________________________________________________;
E→F_____________________________________________________;
(4)请写出一种符合下列条件的H的同分异构体:__________;
①该分子结构中不含甲基;②属于羧酸类物质;③其一氯代物只有3种。
查看答案和解析>>
科目:高中化学 来源: 题型:
要组装一套实验室利用液体和液体反应制备气体的装置,现设计了如下的五步操作 ,正确的程序是①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性(利用固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶中装好分液漏斗,连接好导气管
,正确的程序是①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性(利用固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶中装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
液态化合物AB会发生微弱的自身电离,电离方程式为ABA++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,CO 2饱和溶液的浓度是0.03 mol·L-1,其中的CO2转变为H2CO3,而H2CO3仅有0.1%发生电离:H2CO3
2饱和溶液的浓度是0.03 mol·L-1,其中的CO2转变为H2CO3,而H2CO3仅有0.1%发生电离:H2CO3 H++HC,则溶液的pH约为( )
H++HC,则溶液的pH约为( )
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(写出最佳答案)。
(1)沉淀的化学式:沉淀1____________________,沉淀2__________________,沉淀3________________;
(2)写出混合液+A的离子方程式:__________________________________________
________________________________________________________________________;
溶液1+B的离子方程式:_______________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的He、Ni、Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号________________________________________________________________。
(2)已知氧有三种同位素O、O、O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,R位于元素周期表的第________周期第________族,核稳定性R__________R(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com