
【题目】五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q、M、N含有某种相同的元素。下列说法不正确的是
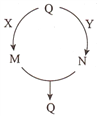
A. 若Q为N2,则X可能为氢气 B. 若Q为A1(OH)3,则Y可能为稀硫酸
C. 若Q为Fe,则Y可能为稀硝酸 D. 若Q为NaHCO3,则X可能为氢氧化钠溶液
【答案】C
【解析】Q、M、N含有某种相同的元素,且Q与不同的物质反应分别得到M和N,M和N又可以反应生成Q。若三者含有相同的元素为变价元素,则M+N→Q为归中反应。也可以考虑两性物质的转化,如Al相关化合物的转化。
A、若Q为N2,X为H2,则M为NH3,共同元素为氮元素,可推测M+N→Q为归中反应,N中氮元素为高价态,可推测Y为O2,N为NO,归中反应为:NO+NH3→N2+H2O,故A正确;B、若Q为A1(OH)3,Y可能为H2SO4,则N为A12(SO4)3,可推断M+N→Q为Al3++AlO2-→A1(OH)3,所以M可以为NaAlO2,X为NaOH,故B正确;C、若Q为Fe,Fe为变价元素,M+N→Q应为归中反应:Fe3++Fe→Fe2+,Q若改为Fe2+,才能实现这相关五种物质的转化,例如Q为FeCl2,X可以为Al,M为Fe,Y为Cl2,N为FeCl3,故C错误;D、若Q为NaHCO3,X为NaOH,M为Na2CO3,Y可以为HCl,N为CO2,故D正确。故选C。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
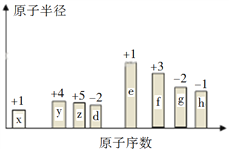
请回答下列问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_________________;比较g、h的最高价氧化物对应的水化物的酸性强弱:________________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L1 R溶液的烧杯中滴加1 mol·L1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
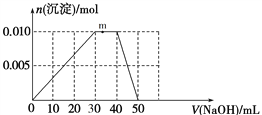
①写出m点反应的离子方程式_____________________________。
②若R溶液改加20 mL1.2 mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是
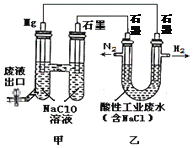
A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
【答案】D
【解析】A、甲中活泼金属镁作原电池的负极,石墨为正极形成原电池,乙是连接原电池的电解池,电解酸性工业废水,电解池是将电能转变为化学能的装置,选项A正确;B、酸性条件下含氮离子氧化时转化为氮气,反应的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+,选项B正确;C、若生成H2和N2的物质的量之比为3:1,根据电极反应6H++6e-=3H2↑、3Cl2 + 2NH4+=N2 + 6Cl-+8H+,则处理后废水的H+浓度增大,pH减小,选项C正确;D、电池工作时,甲池是原电池,原电池中阳离子Na+移向正极石墨电极,选项D不正确。答案选D。
【题型】单选题
【结束】
7
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式,正确的是( )
A. 过量的氨气与氯气反应:2NH3+3Cl2![]() N2+6HCl
N2+6HCl
B. 利用HF雕刻玻璃:SiO2+4H++4F—=SiF4+2H2O
C. 石灰乳吸收泄漏的液氯:2Cl2+2Ca(OH)2=2Ca2++2Cl—+2ClO—+2H2O
D. SO2的尾气处理:OH—+SO2=SO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是
A. 有机物![]() 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
B. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
C. 有机物![]() 中可能共面的原于数最多有17个
中可能共面的原于数最多有17个
D. 乙醛和丙烯醛(![]() )不是同系物,分别与足量H2反应后的产物也不是同系物
)不是同系物,分别与足量H2反应后的产物也不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是( )
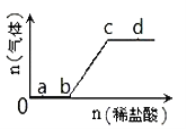
A. a点对应的溶液中:Ca2+、Mg2+、Br—、NO3—
B. b点对应的溶液中:Na+、OH—、Cl—、NO3—
C. c点对应的溶液中:Na+、Ca2+、NO3—、Cl—
D. d点对应的溶液中:F—、NO3—、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆70周年阅兵式,大量新式武器新鲜出炉且都为中国制造,制造这些“国之重器”的材料多为合金。下列关于合金的说法不正确的是
A.合金在工业上的用途比纯金属更广
B.合金的硬度一般比它的成分金属大
C.合金的熔点一般比它的成分金属高
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生.下列属于新能源的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能.
A.①②③④
B.⑤⑥⑦⑧
C.③④⑤⑥
D.除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲酸乙酯的反应装置示意图和有关数据如下:
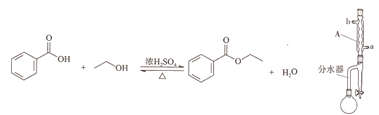
相对分子质量 | 密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
苯甲酸 | 122 | 1.266 | 249 | 微溶 |
乙醇 | 46 | 0.789 | 78.3 | 溶 |
苯甲酸乙酯 | 150 | 1.045 | 213 | 难溶 |
环己烷 | 84 | 0.779 | 80.8 | 难溶 |
环已烷、乙醇和水可形成共沸物,其混合物沸点为62.1℃。
合成反应:向圆底烧瓶中加入6.1g苯甲酸、20mL无水乙醇、25mL环已烷和2片碎瓷片,搅拌后再加入2mL浓硫酸。按图组装好仪器后,水裕加热回流1.5小时。
分离提纯:继续水浴加热蒸出多余乙醇和环已烷,经分水器放出。剩余物质倒入盛有60mL冷水的烧怀中,依次用碳酸钠、无水氯化钙处理后,再蒸馏纯化,收集210~213℃的馏分。得产品5.0g。
回答下列问题:
(1)仪器A的名称为_______,冷却水应从______(填“a”或“b”)口流出。
(2)加入环己烷的目的为______________。
(3)合成反应中,分水器中会出现分层现象,且下层液体逐渐增多,当下层液体高度超过距分水器支管约2cm时开启活塞放出少量下层波体。该操作的目的为_________________。
(4)实验中加入碳酸钠的目的为__________;经碳酸钠处理后,若粗产品与水分层不清,可采取的措施为___________(填字母)。
(5)在该实验中,圆底烧瓶的容积最适合的是_____。
A.50mL B.100mL C.200mL D.300mL
(6)本实验的产率为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com