
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:| 0.8mol |
| 0.1L |
| n |
| V |
| 0.1mol |
| 0.28L |
| n |
| V |
| 0.8mol |
| 0.28L |


科目:高中化学 来源: 题型:
| A、5:7 | B、7:5 |
| C、1:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 |
| B、在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 |
| C、二次电池充电过程是化学能转化为电能的过程 |
| D、二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4 与 C3H4O |
| B、C2H2 与 C6H6 |
| C、CH2O 与 C3H6O2 |
| D、CH4 与 C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
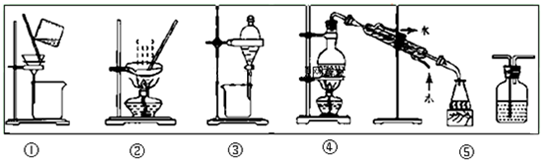
| A、粗盐提纯,选①和② |
| B、用CC14提取碘水中的碘,选③ |
| C、分离Na2CO3溶液和CH3COOC2H5,选④ |
| D、用FeC12溶液吸收C12选⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
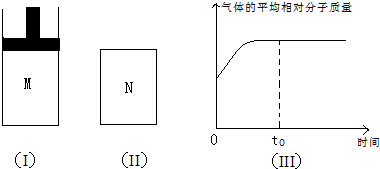
| 可能的情形 | A、B是否为气态 | 与y的大Z小关系 | M(B)与M(C)的大小关系(M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | Z=y | 不确定 |
| ② | ||||
| ③ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| Cl2 |
| O2 |
| O2 |
| H2O |
| A、B和Cl2反应是氧化还原反应 |
| B、当X是强酸时,C在常温下是气态单质 |
| C、当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 |
| D、当X是强碱时,A、B、C、D、E、F中均含同一种元素,F可能是HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com