
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
分析 (1)根据根据该氨水浓度为153mg•L-1,结合n=$\frac{m}{M}$、c=$\frac{n}{V}$计算;
(2)600m3废氨水,结合m=ρV、n=cV计算;
(3)①使NH3恰好完全氧化为NO,根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
②主反应为4NH3+5O2=4NO+6H2O,副反应为4NH3+3O2=2N2+6H2O,混合气体中不含NH3,氨气完全反应,结合O2和N2的物质的量之比为1:10计算;
(4)由表格数据可知,固体质量越大,生成氨气越少,先发生H++OH-=H2O,生成氨气质量最大为1.87g,样品质量增大1倍,氨气的质量不变,可知第一组数据中样品完全反应,利用NaOH完全反应计算生成氨气的质量最大时样品的质量,以此计算.
解答 解:(1)NH3的浓度为153mg•L-1,密度为1g•cm-3,取1L,则含氨气153mg,则氨气的物质的量为:n=$\frac{153×1{0}^{-3}g}{17g/mol}$=9×10-3mol,该废氨水中氨的物质的量浓度为c=$\frac{9×1{0}^{-3}mol}{1L}$=9×10-3mol/L,故答案为:9×10-3mol/L;
(2)n(NH3)=$\frac{(153-17)mg/L}{17g/mol}$×10-3g/mg×600m3×103L/m3=4800 mol,故答案为:4800 mol;
(3)①根据氨气被氧气恰好完全氧化为NO的方程式,可假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O
4 5
4L 0.20y
y=25L,氨-空气混合物中氨的体积分数=$\frac{4L}{4L+25L}$≈0.14,
故答案为:0.14;
②设参加主反应NH3的为x,副反应的NH3为y,
4NH3+5O2=4NO+6H2O
4 5
x $\frac{5x}{4}$
4NH3+3O2=2N2+6H2O
4 3 2
y $\frac{3y}{4}$ $\frac{y}{2}$
则x+y=1,$\frac{2-\frac{5x}{4}-\frac{3y}{4}}{\frac{y}{2}+8}$,解得x=0.89,所以参加主反应的氨占原料氨的体积百分含量为$\frac{0.89}{1}$×100%=89%,
答:参加主反应的氨占原料氨的体积百分含量为89%;
(4)由表格数据可知,固体质量越大,生成氨气越少,先发生H++OH-=H2O,生成氨气质量最大为1.87g,样品质量增大1倍,氨气的质量不变,可知第一组数据中样品完全反应,设(NH4)2SO4、NH4HSO4的物质的量分别为x、y,2x+y=$\frac{1.87g}{17g/mol}$,132x+115y=7.75,解得x=n[(NH4)2SO4]=0.05mol,
y=n(NH4HSO4)=0.01mol,则混合物溶解后,溶液中n(NH4+):n(H+)=11:1,40.00 mL NaOH 溶液中n(NaOH)=0.13mol,NaOH完全反应生成氨气最大,则n(H+)+11×n(H+)=0.13mol,n(H+)=0.13mol×$\frac{1}{12}$=n(NH4HSO4),n[(NH4)2SO4]=0.13mol×$\frac{5}{12}$,混合物质量为0.13mol×$\frac{1}{12}$×115g/mol+0.13mol×$\frac{5}{12}$×135g/mol=8.40g,
答:生成氨气的质量最大时样品的质量为8.40g.
点评 本题考查化学反应方程式及物质的量的有关计算,为高频考点,把握发生的反应及物质的量为中心的基本计算为解答的关键,侧重分析与计算能力的考查,题目难度较大,(4)为解答的难点.


科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于制漂白粉 | B. | 液氨可用作制冷剂 | ||
| C. | 活性炭可以去除冰箱中的异味 | D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纳米管中的镓为液体 | |
| B. | 金属镓的体积在10℃~500℃之间随温度的变化比较均匀 | |
| C. | 碳纳米管的体积在10℃~500℃之间随温度的变化很小 | |
| D. | Al(OH)3、Ga(OH)3均是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
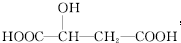
| A. | 苹果酸中能发生酯化反应的官能团有1种 | |
| B. | 1 mol苹果酸可与3 mol NaHCO3发生中和反应 | |
| C. | 1 mol苹果酸与足量金属 Na反应生成生成mol H2 | |
| D. | 1 mol苹果酸可以形成三元或四元环状内酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石跟石墨是同素异形体 | B. | 126C和146C是同位素 | ||
| C. | 不同的核素质子数可能相同 | D. | C2H4和C3H6一定是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com